
| A. | HCl的电子式 | B. | Cl-的结构示意  | ||
| C. | CO2的电子式  | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构;
C.二氧化碳分子中含有两个碳氧双键;
D.元素符号的左上角为质量数、左下角为质子数.
解答 解:A.氯化氢为共价化合物,分子中存在1对共用电子对,氯化氢的电子式为 ,故A错误;
,故A错误;
B.Cl-的核外电子总数为18,最外层含有8个电子,其离子结构示意图为: ,故B正确;
,故B正确;
C.二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳正确的电子式为 ,故C错误;
,故C错误;
D.氯原子的质子数为17,质量数为37的氯原子应该表示为1737Cl,故D错误;
故选B.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | NF3是一种极性分子 | B. | NF3提供孤电子对的能力比NH3强 | ||
| C. | NF3中的N呈+3价 | D. | NF3中的N采取sp3杂化成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O中氧元素的化合价为-l | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | NaOH中氧元素的化合价为-1 | D. | Na2O中氧元素的化合价为-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
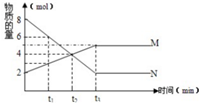 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | a=1.64 | |
| B. | 此时正反应速率大于逆反应速率 | |
| C. | 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)缩合,最多可形成4种二肽 | |
| B. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| C. | 实验室用如图装置证明酸性:醋酸>碳酸>苯酚,①中放入浓醋酸,②中放入CaCO3,③中放入C6H5ONa溶液 | |
| D. | 实验室用如图装置证明乙炔具有还原性,①中放入H2O,②中放入电石,③中放入KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | Na+,Ba2+,NH4+ |
| 阴离子 | CH3COO-,Cl-,OH-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 改变的条件 | 生成的SO3的速率 |
| ① | 降低温度 | 减小 |
| ② | 升高温度 | 增大 |
| ③ | 增大O2的浓度 | 增大 |
| ④ | 恒容下充入Ne | 不变 |
| ⑤ | 压缩体积 | 增大 |
| ⑥ | 使用催化剂 | 增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com