解答:
解:(1)①根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,反应的方程式为:C(s)+H
2O(g)?CO(g)+H
2(g),
故答案为:C(s)+H
2O(g)?CO(g)+H
2 (g);
②A、反应前后气体的体积不相同,容器中气体的平均相对分子质量不断减小,当平均相对分子质量不随时间变化即达到平衡状态,故A正确;
B、υ
正(H
2O)=υ
逆(H
2)时,各组分浓度不再变化,反应达到平衡状态,故B正确;
C、反应物C为固体,反应前后气体质量增大,而容器容积不变,根据
ρ=可知,容器中气体的密度不断增大,当容器中气体的密度不随时间变化时,说明反应达到平衡状态,故C正确;
D、根据质量守恒定律可知,容器中总质量自始至终不随时间而变化,故D错误;
E、消耗n mol H
2的同时消耗n mol CO,表示的都是逆反应,无法判断正逆反应速率是否相等,故E错误;
故答案为:ABC;
(2)已知N
2(g)+3H
2(g)?2NH
3(g)△H=-92.3kJ?mol
-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN
2和3molH
2,达到平衡状态Ⅰ;相同条件下,向另一体积相同的密闭容器中通入0.9molN
2、2.7molH
2和0.2molNH
3,转化起始量为1molN
2和3molH
2,达到平衡时平衡状态Ⅱ和平衡状态Ⅰ相同,互为等效平衡,
①温度不变平衡常数不变,所以两个平衡状态的平衡常数的关系相等:Ⅰ等于Ⅱ,
故答案为:等于;
②达到平衡时平衡状态Ⅱ和平衡状态Ⅰ相同,互为等效平衡,所以H
2的百分含量:Ⅰ等于Ⅱ,
故答案为:等于;
③由于平衡Ⅱ开始时加入了0.2molNH
3,所以N
2的转化生成的氨气的量比平衡Ⅰ少,反应放出的热量反应放出的热量比平衡I少,所以放热热量:Ⅰ大于Ⅱ,
故答案为:大于;
(3)36g碳的物质的量为:n=
=3mol,
不完全燃烧所得气体中,CO占三分之一体积,根据碳原子守恒,求得CO的物质的量为3mol×
=1mol,
根据2CO(g)+O
2(g)═2CO
2(g)△H=-576kJ/mol,
1molCO燃烧放出的热量为:576kJ×
=283kJ,
所以36g碳不完全燃烧生成1molCO损失的热量为283kJ,
故答案为:283.




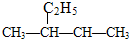 的化学名称是2-乙基丁烷
的化学名称是2-乙基丁烷 (1)已知298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.3kJ.写出该反应的热化学方程式:
(1)已知298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.3kJ.写出该反应的热化学方程式: