
(10分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
(2)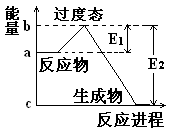 在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO=CO2+NO,2 min时,测得容器中NO的物质的量为0.5mol ,则:
在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO=CO2+NO,2 min时,测得容器中NO的物质的量为0.5mol ,则:
①此段时间内,用CO2表示的平均反应速率为
②2 min时,容器内气体的总物质的量为
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
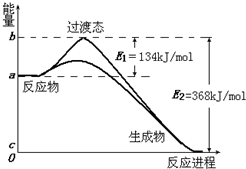

| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.CH3SH B.CH3CH2SH
C.(CH3)2CHSH D.CH3CH2CH2CH2SH
查看答案和解析>>
科目:高中化学 来源: 题型:

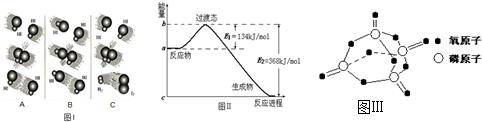
图Ⅰ
图Ⅱ
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是_______(选填“A”“B”或“C”)。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
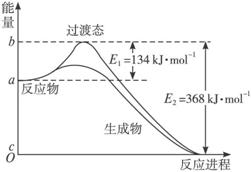
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 197 | 360 | 499 | X |

图Ⅲ
已知白磷的燃烧热为2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(3) 过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
查看答案和解析>>
科目:高中化学 来源:2013届浙江宁波金兰合作组织高二下学期期中联考化学试卷(解析版) 题型:填空题
(10分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;(图中为1molNO2与1molCO的反应)
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。
①在体系中加入催化剂对反应热是否有影响? (填“是”或“否”),原因是 。
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 。(填“增大”、“减小”或“不变”)
③请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com