
| A.锌粉 | B.铜片 |
| C.铁片 | D.镁粉 |
科目:高中化学 来源:不详 题型:单选题
| A. 6.72 L | B.3.36 L | C. 2.24 L | D.以上都不对 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该晶体中没有SCN- | B.Fe3+的氧化性比Cl2的氧化性强 |
| C.Fe2+被Cl2氧化为Fe3+ | D.Fe2+与SCN-形成血红色的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
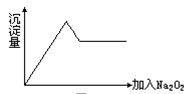 ⑦……。
⑦……。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
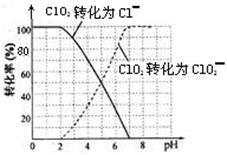
 ,工业上用湿法制备高铁酸钾的基本流程如下图所示:
,工业上用湿法制备高铁酸钾的基本流程如下图所示: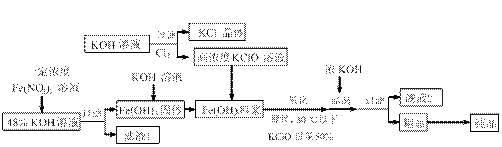
 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4-5 |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+ | D.Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com