
【题目】【化学—选修3物质结构与性质】
氮、磷、砷的单质及其化合物在生产生活中有重要的作用。回答下列问题:
(1)N元素原子核外电子排布图为____________,基态As原子有________种不同能量的电子。
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子中N原子的杂化方式为__________,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是 。
(3)N、P、As氢化物沸点由高到低的顺序是 ,原因是 。
(4)根据结构与性质的关系,说明H3AsO4的酸性比H3AsO3强的原因: 。
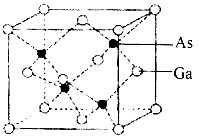
(5)砷化镓属于第三代半导体,晶胞结构如图。晶胞中距离Ga原子等距最近的Ga原子有 个,Ga与周围等距最近的As形成的空间构型为____________。已知砷化镓晶胞边长为a pm,NA表示阿伏加德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
【答案】除标注外,其余每空均2分
(1)![]() (1分) ;8(1分)
(1分) ;8(1分)
(2)sp2杂化(1分);O>N> Co >K
(3)NH3>AsH3>PH3;NH3分子间能形成氢键,沸点最高,AsH3与PH3都为分子晶体,但AsH3相对分子质量更大,分子间作用力更大,沸点更高。
(4)H3AsO4的非羟基氧个数比H3AsO3的多,所以酸性更强。
(5)12(1分);正四面体(1分);
【解析】
试题分析:
(1)N元素原子核外电子排布图为![]() ,基态As原子有1s、2s、2p、3s、3p、3d、4s、4p八个能级,即八种不同能量的电子。
,基态As原子有1s、2s、2p、3s、3p、3d、4s、4p八个能级,即八种不同能量的电子。
(2)NO2-离子中N原子的价层电子对数为3对,故采取sp2杂化;电负性与非金属性一致,所以K3[Co(NO2)6] 中四种元素的电负性由大到小的顺序是O>N> Co >K。
(3)N、P、As氢化物沸点由高到低的顺序是NH3>AsH3>PH3,原因是NH3分子间能形成氢键,沸点最高,AsH3与PH3都为分子晶体,但AsH3相对分子质量更大,分子间作用力更大,沸点更高。
(4)H3AsO4的酸性比H3AsO3强,是因为H3AsO4的非羟基氧个数比H3AsO3的多,所以酸性更强。
(5)晶胞中距离Ga原子等距最近的Ga原子有12个,Ga与周围等距最近的As形成的空间构型为正四面体。密度=晶胞的质量÷晶胞的体积= 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是

A双酚A的分子式是C15H16O2
B.反应①中,1mol双酚A最多消耗2 mol Br2
C.反应②的产物中只有一种官能团
D.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相似相溶规则和实际经验,下列叙述不正确的是 ( )
A. 白磷(P4)易溶于CS2,但难溶于水
B. NaCl易溶于水,难溶于CCl4
C. 碘易溶于苯,微溶于水
D. 卤化氢易溶于水,也易溶于CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在废水处理领域中,H2S 或 Na2S 能使某些金属离子生成极难溶的硫化物而除去。25℃, 某溶液含 0.02 molL-1Mn2+、0.1 molL-1 H2S,向该溶液中通入 HCl 气体或加入 NaOH 固体以 调节溶液 pH,(忽略溶液体积的变化、H2S 的挥发)。当溶液的 pH=5 时,Mn2+开始沉淀为 MnS,则 MnS 的溶度积为( )(已知:H2S 两级电离常数分别为 Ka1=1.3×10-7,Ka2=7.0×10-15)
A. 1.3×10-7 B. 7.0×10-15
C. 9.1×10-14 D. 1.82×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列概念的依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:本质不同的原因是能否发生丁达尔现象
C. 强电解质与弱电解质:溶液的导电能力大小
D. 氧化还原反应的本质:有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A.金属Na着火,立即用水扑灭
B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)实验室制取乙炔___________________。
(2)2 -氯丙烷的消去反应___________________。
(3)用甲苯制TNT的反应___________________。
(4)l,2-二氯乙烷与NaOH溶液共热___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有 ( )
①蛋白质的变性 ②蛋白质的盐析
③胶体聚沉 ④盐类水解
⑤焰色反应 ⑥氧化还原反应
A.①②③④
B.①③④⑥
C.②③④⑤
D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______________.
(2)反应Ⅰ完成后,铁元素的存在形式为_____________.(填离子符号)请写出生成该离子的离子方程式_________________________.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________。
(4)书写出由沉淀C制备铝的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com