
【题目】![]() 时,在“
时,在“![]() ”的水溶液体系中,
”的水溶液体系中,![]() ,
,![]() 和
和![]() 三者中各自所占的物质的量分数
三者中各自所占的物质的量分数![]() 随溶液pH变化的关系如图所示。下列说法正确的是
随溶液pH变化的关系如图所示。下列说法正确的是
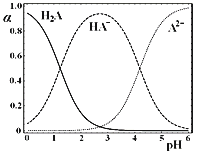
A.在含![]() A、
A、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 一定增大
一定增大
B.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
C.NaHA溶液中,![]() 的水解能力大于
的水解能力大于![]() 的电离能力
的电离能力
D.在含![]() A、
A、![]() 和
和![]() 的溶液中,若
的溶液中,若![]() ,则
,则![]() 与
与![]() 不一定相等
不一定相等
【答案】D
【解析】
A.根据图象,加入少量NaOH固体,pH增大,α(HA-)先增大后减小,所以α(HA-)不一定增大,故A错误;
B.NaHA的电离程度和Na2A的水解程度不同,故所得的溶液中α(HA-)与α(A2-)不相等,故B错误;
C.根据图象,NaHA溶液显酸性,即HA-电离出氢离子使溶液呈酸性,则c(H+)>c(OH-),故HA-的水解能力小于HA-的电离能力,故C错误;
D.在含H2A、HA-和A2-的溶液中,存在电荷守恒:c(H+)=c(OH-)+c(HA-)+2c(A2-),若c(H2A)+2c(A2-)+c(OH-)=c(H+),则c(H2A)和c(HA-)相等,所以α(H2A)和α(HA-)一定相等,故D正确;
故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在某温度时将 ![]() 氨水滴入
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 常温下某溶液中由水电离出的离子浓度符合
常温下某溶液中由水电离出的离子浓度符合![]() 的溶液,其pH为 ______ ,此时水的电离受到 ______ .
的溶液,其pH为 ______ ,此时水的电离受到 ______ .
![]() 已知:
已知:![]() 一定温度下,在密闭容器中反应
一定温度下,在密闭容器中反应![]() 达到平衡.其他条件不变时,下列措施能提高
达到平衡.其他条件不变时,下列措施能提高![]() 转化率的是 ______
转化率的是 ______ ![]() 填字母
填字母![]() .
.
A.减小![]() 的浓度
的浓度![]() 降低温度
降低温度![]() 增加
增加![]() 的浓度
的浓度![]() 升高温度
升高温度
![]() 在某温度下,
在某温度下,![]() 的离子积常数为
的离子积常数为![]()
![]() ,则该温度下:
,则该温度下:
![]() 溶液的
溶液的![]() ______ ;
______ ;
![]()
![]() 溶液与100mL
溶液与100mL![]() 的KOH溶液混合后,
的KOH溶液混合后,![]() _____
_____
![]() 已知一溶液有4种离子:
已知一溶液有4种离子:![]() 、
、![]() 、
、![]() 、
、![]() ,下列分析结果肯定错误的是 ______
,下列分析结果肯定错误的是 ______
A.![]()
![]()
C.![]()
![]()
![]() 在
在![]() 下,将a
下,将a![]() 的氨水与
的氨水与![]() 的盐酸等体积混合,反应时溶液中
的盐酸等体积混合,反应时溶液中![]() 则溶液显 ______
则溶液显 ______ ![]() 填“酸”“碱”或“中”
填“酸”“碱”或“中”![]() 性;用含a的代数式表示
性;用含a的代数式表示![]() 的电离常数
的电离常数![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:__________________。
(2)反应I的化学方程式为________________________。
(3)“灼烧”时发生反应的化学方程式:______________。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为__________________。
(5)副产品X的化学式是____________。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃24mL,与过量氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度和压强,气体总体积缩小了54mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
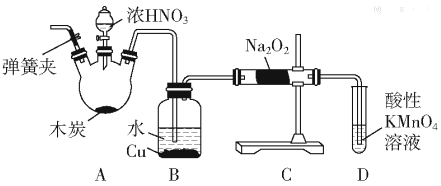
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检査完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是___。
(2)B中观察到的主要现象是___;
(3)A装置中反应的化学方程式为___;
(4)D装置中反应的离子方程式___;
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和___。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为___。
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com