
| A. | 已达平衡状态 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的正极和负极不一定是两种不同的金属 | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 可逆反应2SO2+O2?2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,Qc变小,K不变,O2转化率减小 | |
| D. | 如果△H和△S均为正值,当高温时,反应可能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
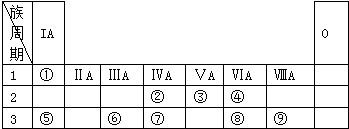
 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  属于环状化合物 属于环状化合物 | B. |  属于卤代烃 属于卤代烃 | ||
| C. | 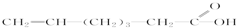 属于链状化合物 属于链状化合物 | D. | 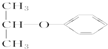 属于醚 属于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| D. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| B. | 将乙醇迅速加热至170摄氏度制乙烯 | |
| C. | 将还原铁粉、液溴和苯混合制溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
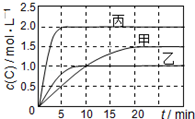 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min) | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡移动 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

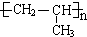 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com