
����Ŀ��ij��ѧ��ȤС���ͬѧ���в�����������(FeC2O4��nH2O)�ֽ��ʵ��̽������С�����ۣ��������������װ�ý���ʵ�顣 ��ƿB��ʢ�б���NH4Cl�ͱ���NaNO2���Һ(������ʵ������N2)�������C1��C4��װ�м�ʯ�ң��Թ�E1��E3��E4��װ�г���ʯ��ˮ��
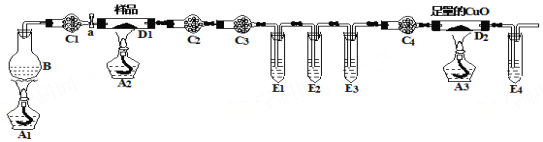
��1����ַ�Ӧ��D1�еĹ��������Ͷ����������е�ϡ�����У�������ȫ�ܽ���������ų���ȡ��ӦҺ����KSCN��Һ��Ѫ��ɫ��֤���������Ϊ ��д��ѧʽ����
��2����װ������3���ƾ��ƣ�����ʵ���������Ӧ�õ� �ξƾ��ƣ����һ�ε�ȼ���� ������ƾ����µ���ĸ��
��3����ʵ��װ������4��ֱ�����Թܣ�������ʢ���Լ����ֲ�ͬ�����ã�����E3�������ǣ� ��
��4����ʵ��װ������4������ܣ�C3��ʢװ���Լ��� ��
��5��ȡ7.2 g��Ʒ��ַ�Ӧ���D1�еĹ��������Ϊ2.88 g��D2�й�����������0.64 g���������������(FeC2O4��nH2O)�ֽ�ķ���ʽΪ ��
���𰸡���1��FeO����2��4��A1����3����֤�����е�CO2�Ƿ�������
��4��P2O5��CaCl2����5��FeC2O42H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��
��������
�����������1��������������е�ϡ���ᣬ��ֹ������Ӱ��ʵ�飨Fe2��������Fe3�����������������˵����CO32��������KSCN��Һ��Ѫ��ɫ��˵����Ԫ���ԣ�2�۴��ڣ���˹��������FeO��(2)A3�Ǽ��黹ԭ������ڣ���������CO��CO�ǿ�ȼ�����壬��Ҫ���鴿�ȣ���ֹ����Σ�գ������Ҫ4�ε�ȼ�ƾ��ƣ����һ�ε�ȼ�ƾ�����A1��Ŀ���Dz���N2����FeC2O4�ֽ���������壬ȫ�������գ���3��E1�Ǽ���FeC2O4�ֽ���������Ƿ���CO2��E3����֤�����е�CO2�Ƿ���������4��C2�������Ǽ���ˮ������ʢ����ˮ����ͭ��C3�����ÿ����Ƿ�ֹE1��ˮ��������C2���������ţ�C3ʢ�Ÿ������������ʢ�ż�ʯ�һ���ʯ�ң����Ӧ��P2O5��CaCl2��(5)����(1) ��������FeO�������ʵ���Ϊ2.88/72mol=0.04mol��������Ԫ���غ㣬FeC2O4��nH2O�����ʵ���Ϊ0.04mol��D2������������0.64g�����ٵ���ԭ�ӵ�����Ϊ0.64g����CO�����ʵ���Ϊ0.64/16mol=0.04mol������̼Ԫ���غ㣬CO2�����ʵ���Ϊ0.04mol����������Ϊ7.2g�������7.2/(144��18n)=0.04�����n=2����˲�����������Ļ�ѧʽΪFeC2O4��2H2O��������ȷֽ�ķ�Ӧ����ʽΪ��FeC2O42H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1��0.2molO3��0.3molO2������___________��ѡ���������������������������ж�������������֮��Ϊ__________������ԭ����֮��Ϊ___________������ͬ�����µ����֮��Ϊ_____________��
��2��73gHCl�����к���_____________�����ӣ���״����ռ�е����Ϊ_____________L��
��3����ͬ���ʵ���Ũ�ȵ�KCl��MgCl2��AlCl3������Һ���ֱ���AgNO3��Һ��Ӧ�������ɵ�AgCl�ij���������֮��Ϊ3��2��1ʱ��������Һ�������Ϊ__________��
��4����״����VL�Ȼ��������ܽ���1Lˮ�У�������Һ���ܶ�Ϊ��gmL����Һ�����ʵ���������Ϊ�������ʵ���Ũ��ΪcmolL-1������=__________����дһ�ֱ���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ�������ȷ���ǣ� ��
A. �������ᾧ�ķ�������̼���ƺ�ˮ
B. �ù��˵ķ�������ֲ���ͺ�ˮ
C. ������ķ�������ƾ���ˮ
D. ����ȡ�ͷ�Һ�ķ�����CCl4�ӵ�ˮ����ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����25 mL 0.1 mol��L��1 NaOH��Һ����μ���0.2 mol��L��1������Һ���ζ�������ͼ��ʾ������˵����ȷ����

A����A��B����һ�����Һ��һ�����У�c(Na��)��c(CH3COO��)��c(OH��)��c(H��)
B��Ka(CH3COOH)��![]()
C��C���Ӧ����Һ�У�ˮ�������H��Ũ�ȴ���10��7 mol��L��1
D��D���Ӧ����Һ�У��������¹�ϵ��c(CH3COO��)��c(CH3COOH)��2c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sr)Ԫ�ع㷺�����ڿ�Ȫˮ�У���һ������������Ԫ�أ���Ԫ�����ڱ����� Ca ��Baͬ����ͬ�塣
��1��Sr ��ԭ�������� �����ԣ�Sr(OH)2 Ba(OH)2(���������)���ȵĻ�ѧ������ƺͱ����ƣ���ԭ�ӽṹ�Ĺ۵������ԭ���� ��
��2��̼����������Ҫ���Ȼ�����ú�SrSO4������BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2������ʯ�Ʊ�SrCO3��������������(���ֲ�����������)��
I��������ʯ��ۺ�Na2CO3��Һ��ֻ�ϣ����ˣ�
II���������������ᣬ���ˣ�
III������������Һ�м���Ũ���ᣬ���ˣ�
IV������������Һ���ȼ�������ᣬ��ַ�Ӧ�����ð�ˮ��pHԼΪ7�����ˣ�
V������������Һ�м����Թ���NH4HCO3����ַ�Ӧ���ˣ�������ϴ������ɣ��õ�SrCO3��
��֪��i����ͬ�¶�ʱ��Ksp ��BaSO4��SrCO3��SrSO4��CaSO4
ii�������������������pH

��֪�������������ܶȻ�Ϊ1��10��15��Fe2+��ȫ������pHֵΪ ����ȫ����ʱFe2+��Ũ��С��1��10��5��
��I�У���Ӧ�Ļ�ѧ����ʽ�� ��
��II�У��������ᷴӦ�ܽ�������� ��
�������������й����ӷ���ʽΪ ��IV���백ˮ��Ŀ���� ��
�����й��ڸù������̵�˵����ȷ���� ��
a���ù��ղ����ķ�Һ���϶��Na+ ��Cl- ��SO42-
b��V�з�Ӧʱ�������¶�һ���������SrCO3����������
c��V�з�Ӧʱ������NaOH��Һһ���������NH4HCO3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ����䣨1 L�����ܱ������У�����3 mol PCl3��4 mol Cl2ʹ֮������ӦPCl3(g)+Cl2(g) ![]() PCl5(g)��ƽ��ʱ������ѹǿΪ��ʼʱ��
PCl5(g)��ƽ��ʱ������ѹǿΪ��ʼʱ��![]() ��
��
���㲢�ش�
��1��ƽ��ʱ�������������ܶ��ǿ�ʼʱ��___________��������ƽ����Է��������ǿ�ʼʱ��_________����
��2������ͬһ��Ӧ�¶ȣ�������ʼ���Ϊa mol PCl3��b mol Cl2��c mol PCl5����ʹƽ��ʱPCl5���������Ϊ![]() ����a��b��c����Ĺ�ϵΪ �� ����ʹ��ʼʱ��Ӧ���淽����У���a��ȡֵ��ΧΪ �� b��ȡֵ��ΧΪ ��c��ȡֵ��ΧΪ
����a��b��c����Ĺ�ϵΪ �� ����ʹ��ʼʱ��Ӧ���淽����У���a��ȡֵ��ΧΪ �� b��ȡֵ��ΧΪ ��c��ȡֵ��ΧΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܴ���������ǣ� ��
A.Na+��Al3+��Cl����OH��
B.H+��Na+��CO32����NO3��
C.Cu2+��K+��SO42����NO3��
D.Na+��H+��OH����Ca2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.56 g�ԣ�1�۵�ij����������������ȫ��Ӧ������0.04 g��������ý�����Ħ������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ���ҵ�β���к��н϶���������ж���Ҫ������Щβ���������Լ����ʺϵ��ǣ� ��
A.Ca��OH��2 ��Һ
B.����NaCl��Һ
C.����ˮ
D.NaOH��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com