
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
|
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
物质的量浓度和溶解度专题;电离平衡与溶液的pH专题.
分析:
酸碱中和的实质是:H++OH﹣=H2O,当H+与OH﹣恰好完全反应时,依据二者的物质的量相等,可求强酸(或强碱)的浓度或体积,若H+或OH﹣过剩,则用“对消﹣稀释法“,先求剩余的c(H+)或c(OH﹣),再进一步求混合溶液的pH.
解答:
解:据题意,一元强酸和一元强碱恰好反应,故有H+与OH﹣的物质的量相等,设强酸的体积为V,则强碱的体积为10V,有V•10﹣2.5=10V•10PH﹣14,解得PH=10.5.
故选C.
点评:
本题主要考查学生强酸和强碱混合后溶液PH的计算,解此类题型的要点是H++OH﹣=H2O.


科目:高中化学 来源: 题型:
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e﹣═4OH﹣
C. 每转移0.1 mol电子,消耗标准下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是()
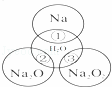
A. 反应③最多能产生0.05mol O2
B. 反应①的离子方程式为:Na+2H2O═Na++2OH﹣+H2↑
C. Na2O2中阴阳离子数目之比为1:1
D. ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
|
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
|
| A. | 酸式滴定管用蒸馏水洗涤后未用标准液清洗 |
|
| B. | 开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失 |
|
| C. | 滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数 |
|
| D. | 达到滴定终点时,仰视读数并记录 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol.
② 和 两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣) D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3•H2O),混合后溶液中c(NH4+)与c(Cl﹣)的关系c(NH4+) c(Cl﹣).
查看答案和解析>>
科目:高中化学 来源: 题型:
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
|
| A. | 放电时正极附近pH增大 |
|
| B. | 充电时阴极的电极反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣ |
|
| C. | 放电时电解质溶液中的阴离子向正极方向移动 |
|
| D. | 蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知多硫化钠Na2Sx(x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:10,则x值是()
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com