
25℃时,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近于( )
A.8.3 B.8.7 C.9 D.9.7
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:海南省琼海市嘉积中学2011-2012学年高二上学期教学质量监测(二)化学试题 题型:022
在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:
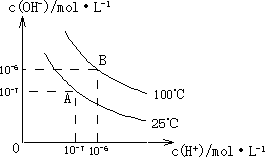
(1)A点水的离子积为1×10-14,B点水的离子积为________.造成水的离子积变化的原因是________.
(2)25℃时,H2R在水溶液中的电离方程式为:
H2R=H++HR-,HR-![]() H++R2-
H++R2-
①0.1 mol/L H2R溶液的pH________1(“>”、“<”或“=”).
②在0.1 mol/L NaHR溶液中,各离子浓度由大到小的顺序是:________.
(3)100℃时,0.01 mol/L NaOH溶液的pH=________.
(4)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为________.
查看答案和解析>>
科目:高中化学 来源:海南省嘉积中学2010-2011学年高二教学质量监测化学理科试题(二) 题型:022
在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:
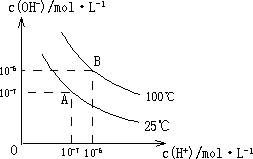
(1)A点水的离子积为1×10-14,B点水的离子积为________.造成水的离子积变化的原因是________.
(2)25℃时,H2R在水溶液中的电离方程式为:
H2R=H++HR-,HR-①0.1 mol/L H2R溶液的pH________1(填“>”、“<”或“=”).
②在0.1 mol/L NaHR溶液中,各离子浓度由大到小的顺序是:________.
(3)100℃时,0.01 mol/L NaOH溶液的pH=________.
(4)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为________.
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二下学期期中考试化学试题 题型:填空题
(8分)水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为 。(原子量Ca:40,O:16,H:1)
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com