
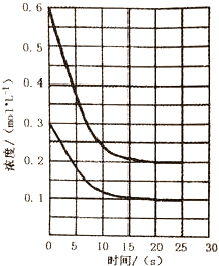
| A. | 从投料到20s时达到平衡,v(A)的反应速率为0.02mol•L-1•s-1 | |
| B. | 若该反应的化学平衡常数K=250,说明D的状态为气态 | |
| C. | 降低温度,有利于加快化学反应速率和提高反应的转化率 | |
| D. | 若D是固体且保持平衡的温度和压强不变,再向容器中充入3mol的B,则此时v正<v逆 |
分析 从图中可知:2条曲线浓度的变化分别是0.3mol/L减少到0.1 mol/L,从0.6mol/L减少到0.2mol/L,改变量为1:2,浓度改变量之比等于化学计量数之比,
所以对于反应A(g)+2B(g)?C(s)+D(?)△H<0来说,反应物A初始浓度是0.3mol/L,B的初始浓度是0.6 mol/L,
达平衡时,△c(A)=0.2mol/L,△c(B)=0.4mol/L,c平(A)=0.1mol/L,c平(B)=0.2mol/L,容器体积为10L,n平(A)=1mol,n平(B)=2mol,据此分析,
A.浓度保持不变时达到平衡,再根据化学反应速率等于单位时间内物质浓度的变化量来计算;
B.化学平衡常数=$\frac{生成物平衡浓度系数次幂的乘积}{反应物平衡浓度系数次幂的乘积}$来计算,固体不列入,再进行判断;
C.降低温度,化学反应速率减慢,化学平衡向着放热方向进行;
D.若D是固体且保持平衡的温度和压强不变,再向容器中充入3molB,K不变,用浓度熵判断.
解答 解:A.从反应开始至20s,反应物的浓度保持不变,达到平衡状态,v(A)=$\frac{△c(A)}{△t}$=$\frac{0.2mol/L}{20s}$=0.01mol/(L•s),故A错误;
B.当D为气态,平衡常数K=$\frac{{c}_{平}(D)}{{c}_{平}(A){{c}_{平}}^{2}(B)}$,c平(A)=0.1mol/L,c平(B)=0.2mol/L,c平(D)=△c(A)=0.2mol/L,K=$\frac{0.2}{0.1×0.{2}^{2}}$=50,而该反应的化学平衡常数K=250,说明D不是气体,故B错误;
C.降低温度,化学反应速率减慢,化学平衡向着放热方向进行,即正方向移动,转化率得到提高,故C错误;
D.若D是固体且保持平衡的温度和压强不变,平衡常数不变,平衡常数K=$\frac{1}{{c}_{平}(A){{c}_{平}}^{2}(B)}$=$\frac{1}{0.1×0.{2}^{2}}$=250,平衡时n平(A)=1mol,n平(B)=2mol,再向容器中充入3mol的B,物质的量加倍,保持压强不变,容器体积加倍,A的浓度减半变为0.05mol/L,B的浓度变为(2mol+3mol)÷20L=0.25mol/L,Qc=$\frac{1}{0.05×0.2{5}^{2}}$=320>K=250,则平衡将要向逆方向移动,此时v正<v逆,故D正确;
故选D.
点评 本题是一道关于化学反应速率和化学平衡移动的综合考查题,考查学生分析和解决问题的能力,D选项用浓度熵来判断平衡的移动,难度较大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3体积/mL | 26.90 | 26.55 | 27.00 | 26.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10O | B. | C4H4O2 | C. | C3H6O2 | D. | C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答| A | He | ||||||||||||||||
| G | C | D | |||||||||||||||
| B | E | F | I | H | |||||||||||||
| Fe | Cu | ||||||||||||||||
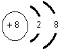 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )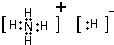 (填电子式).
(填电子式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
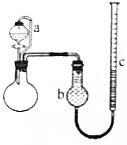 某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:
某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com