
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
分析 A.高效低毒的农药,残留量低;
B.生石灰是干燥剂;
C.水垢应用酸来清洗;
D.明矾水解生成氢氧化铝胶体,胶体具有吸附性而净水;但明矾不能吸附可溶性的物质.
解答 解:A.高效低毒的农药可降低作物的农药残留量,故A正确;
B.生石灰是干燥剂,不能作抗氧化剂,故B错误;
C.水垢应用酸来清洗,比如生活中常用含有醋酸的食醋来清洗,故C错误;
D.明矾水解生成氢氧化铝胶体,胶体能吸附水中悬浮物而净水;但明矾不能吸附可溶性的物质,所以不能进行海水淡化,故D错误.
故选A.
点评 本题考查化学在生活中的应用,明确物质的性质是解本题关键,性质决定用途,用途体现性质,学会利用化学知识解释生活现象,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题
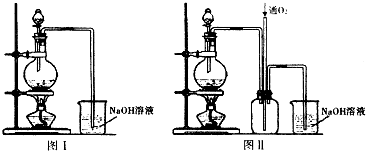
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在常温下可以和氢气发生反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量最高 | |
| C. | 硅和任何酸都不反应 | |
| D. | 硅在电子工业上是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
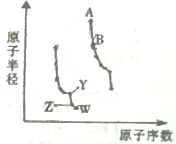 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶用蒸馏水洗净后需晾干才能使用 | |
| B. | 需称取NaC1O固体144g | |
| C. | 所配得NaC1O消毒液久置后会失效 | |
| D. | 8 4消毒液的消毒原理是利用了NaClO的强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量SO2气体:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeI2溶液中通入C12至Fe2+恰好完全被氧化:2Fe2++C12═2Fe3++2C1- | |
| C. | NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
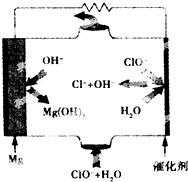 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与7.1g Cl2充分反应,转移电子数0.3NA | |
| B. | 1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA | |
| C. | 3mol NO2与水充分反应时转移电子数2NA | |
| D. | 87g MnO2与含4NA HCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com