
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
科目:高中化学 来源: 题型:选择题
| A. | 先滴加BaCl2溶液再滴加HCl溶液,生成白色沉淀,原溶液中有SO42- | |
| B. | 滴加氯水和CCl4,振荡、静置,上层溶液显紫色,原溶液中有I- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,原溶液中有Na+ | |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性 | |
| B. | 质量数相等的不同核素,一定属于不同种元素 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 自行车钢架生锈主要是化学腐蚀所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 放电时,电解质中的阳离子(EMl+)未发生反应 | |
| C. | 放电时,负极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
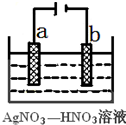 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CHCl3含氯原子数为3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氢原子数为0.4NA | |
| C. | 常温常压下,11.2g乙烯中共用电子对数为2.4NA | |
| D. | 6.4 g CaC2晶体中所含的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| D. | 已知苯甲酸的酸性比碳酸强,向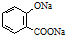 溶液中通入过量CO2: 溶液中通入过量CO2: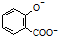 +2CO2+2H2O→ +2CO2+2H2O→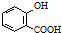 +2HCO3- +2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | |||
| 丁 |
| A. | 原子半径:丙>丁 | |
| B. | 甲与丁的核外电子数相差10 | |
| C. | 氢氧化物碱性:丙>乙 | |
| D. | 甲、乙的最高价氧化物均是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com