
����Ŀ�����ڱ���ǰ������Ԫ��R��W��X��Y��Z��ԭ���������ε�����R��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��ӣ���ҵ��ͨ������Һ̬�������X���ʣ�Yԭ�ӵ���������������Ӳ���֮������R��W��X����Ԫ�ص�ԭ������֮�ͣ�Z��̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ���ش��������⣺
��1��Z2+��̬��������Ų�ʽΪ ��
��2��YX4���Ŀռ乹��������YX4����Ϊ�ȵ������һ�ַ���Ϊ���ѧʽ����HYX4���Ա�HYX2ǿ����ԭ���� ��
��3���ṹ��ʽΪRX��W2H3��2�Ļ�������Rԭ�ӵ��ӻ��������Ϊ��1molRX��W2H3��2�����к��ЦҼ���ĿΪ ��
��4����Z����������Һ��ͨ�������WH3 �� ������[Z��WH3��4]SO4 �� ����˵����ȷ���� ��
A.[Z��WH3��4]SO4�������Ļ�ѧ�������Ӽ������Լ�����λ��
B.��[Z��WH3��4]2+��Z2+�����¶Ե��ӣ�WH3�ṩ�չ��
C.[Z��WH3��4]SO4���Ԫ���е�һ��������������Ԫ��
��5��ijY��Z�γɵĻ�����ľ�����ͼ��ʾ���ڵ����Zԭ�ӣ��� 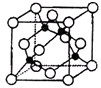
�ٸþ���Ļ�ѧʽΪ ��
����֪Z��Y�ĵ縺�Էֱ�Ϊ1.9��3.0����Y��Z�γɵĻ���������������ӡ��������ۡ��������
����֪�þ�����ܶ�Ϊ��g��cm��3 �� ����٤������ΪNA �� ��þ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊpm��ֻд����ʽ����
���𰸡�
��1��1s22s22p63s23p63d9
��2���������壻CCl4�ȣ�HClO4�� 3 �����ǻ������� HClO2�� 1 �����ǻ���
��3��sp2��11NA
��4��A
��5��CuCl�����ۣ�![]() ��
�� ![]() ��1010
��1010
���������⣺���ڱ���ǰ������Ԫ��R��W��X��Y��Z��ԭ���������ε�����R��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��ӣ���������Ų�ʽΪ1s22s22p2 �� ��RΪCԪ�أ���ҵ��ͨ������Һ̬�������X���ʣ����ԭ��������֪XΪOԪ�ء�WΪNԪ�أ�Yԭ�ӵ���������������Ӳ���֮������R��W��X����Ԫ�ص�ԭ������֮�ͣ���Ԫ��ԭ������֮��Ϊ6+7+8=21����YΪClԪ�أ�Z��̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�ԭ�����������ȣ����ڵ������ڣ����������Ϊ2+8+18+1=29����ZΪCu����1��Cu2+��̬��������Ų�ʽΪ��1s22s22p63s23p63d9 �� ���Դ��ǣ�1s22s22p63s23p63d9����2��ClO4����Clԭ�ӹµ��Ӷ���= ![]() =0���۲���Ӷ���=4+0=4������ռ乹�����������壬��ClO4����Ϊ�ȵ������һ�ַ��Ӻ���5��ԭ�ӡ�32���۵��ӣ��÷���ΪCCl4�ȣ�HClO4�� 3 �����ǻ������� HClO2�� 1 �����ǻ�����HClO4���Ա�HClO2ǿ��
=0���۲���Ӷ���=4+0=4������ռ乹�����������壬��ClO4����Ϊ�ȵ������һ�ַ��Ӻ���5��ԭ�ӡ�32���۵��ӣ��÷���ΪCCl4�ȣ�HClO4�� 3 �����ǻ������� HClO2�� 1 �����ǻ�����HClO4���Ա�HClO2ǿ��
���Դ��ǣ��������壻CCl4�ȣ�HClO4�� 3 �����ǻ������� HClO2�� 1 �����ǻ�������3���ṹ��ʽΪCO��N2H3��2�Ļ�������̼ԭ���γ�3���Ҽ���û�й¶Ե��ӣ��ӻ������ĿΪ3��̼ԭ�ӵ��ӻ��������Ϊsp2��
�ṹ��ʽΪO=C��NH��NH2��2 �� �����к���11���Ҽ���1molRX��W2H3��2�����к��ЦҼ���ĿΪ11NA ��
���Դ��ǣ�sp2��11NA����4����CuSO4��Һ��ͨ�������NH3 �� ������[Cu��NH3��4]SO4 ��
A��[Cu��NH3��4]SO4������������������֮���γ����Ӽ���ͭ�����백������֮���γ���λ��������������������к��м��Լ�����A��ȷ��
B����[Cu��NH3��4]2+��Cu2+�ṩ�չ����NH3�����¶Ե��ӣ���B����
C���ǽ�����Խǿ����һ������Խ��Ԫ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ�����Ԫ�صģ�[Cu��NH3��4]SO4���Ԫ���е�һ������������NԪ�أ�
��ѡ��A����5��ijY��Z�γɵĻ�����ľ�����ͼ��ʾ���ڵ����Zԭ�ӣ����پ����к�ɫ����ĿΪ4����ɫ����ĿΪ8�� ![]() +6��
+6�� ![]() =4���þ���Ļ�ѧʽΪCuCl��
=4���þ���Ļ�ѧʽΪCuCl��
���Դ��ǣ�CuCl������֪Z��Y�ĵ縺�Էֱ�Ϊ1.9��3.0�����ߵ縺��֮��С��1.7����Y��Z�γɵĻ��������ڹ��ۻ����
���Դ��ǣ����ۣ��ۺ�ɫ������Χ��4����ɫ�����ڣ��γ���������ṹ����ɫ���뾧�������ɫ�����ߴ��ھ�������Խ����ϣ�Ϊ���߾���Ϊ��Խ��߳��ȵ� ![]() ������Խ��߳���Ϊ�����ⳤ��
������Խ��߳���Ϊ�����ⳤ�� ![]() ������������Ϊ4��
������������Ϊ4�� ![]() g���þ�����ܶ�Ϊ��g��cm��3 �� ���ⳤΪ
g���þ�����ܶ�Ϊ��g��cm��3 �� ���ⳤΪ 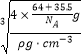 =
= ![]() cm���ʸþ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊ
cm���ʸþ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊ ![]() ��
�� ![]() cm=
cm= ![]() ��
�� ![]() ��1010 pm��
��1010 pm��
���Դ��ǣ� ![]() ��
�� ![]() ��1010 ��
��1010 ��


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ˮ��Һ�д����������
A. H+��Na+��SO42-��Cl-
B. K+��Cu2+��Cl-��OH-
C. Mg2+��Ba2+��CO32-��SO42-
D. Ag+��Ca2+��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���ֻ�����е���ҩ��е������ϣ����ǵĽṹ��ʽ������ʾ�� 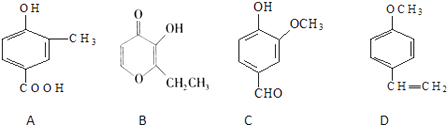
��1��������A�ķ���ʽ����A�к��еĹ����ŵ���������
��2��A��B��C��D���ֻ������л�Ϊͬ���칹�������
��3��������B�ĺ˴Ź��������г�����壻
��4��1molD�������mol�����������ӳɷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽ��ӦĿ���ǣ� ��
ѡ�� | A | B | C | D |
ʵ����� |
|
|
|
|
ʵ��Ŀ�� | ���Ҷ�����HOCH2CH2OH��ת��Ϊ�Ҷ��ᣨH2C2O4�� | �Ƚ��Ȼ����Ͷ������̶�H2O2�ֽⷴӦ�Ĵ�Ч�� | ֤��ϡ������ͭ��Ӧʱ���ֳ������� | ��SO2��Ba��NO3��2��Ӧ���BaSO3���� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ܽ⡢���ˡ������Ȳ������ɽ����и���������ʷ����������
A. �Ȼ��� ̼��� B. ����ͭ ��������
C. ������ �������� D. ����ͭ ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�ǻ��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ������˵���������

A. ������KSCN��Һ����FeSO4��Һ�Ƿ����
B. ������������CO2����ų�
C. ���������ij��ò����������ձ���©���Ͳ�����
D. ��ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���û����������ʱ��������ˮ��������Ӧ�����ڸ����£���������ˮ������Ӧ��
��1��������ˮ������Ӧ�Ļ�ѧ����ʽ��________________________________��
��2��ֹͣ��Ӧ����װ����ȴ��ȡ����Ӧ��Ļ������������ϡ�����ַ�Ӧ�����ˡ���������������Һ�к���Fe3+�IJ�������:______________________________��
��3��������������Һ�в���Fe3+���ⲻ��˵��������ˮ������Ӧ���õIJ����в���+3�۵�����ԭ����(��ϻ�ѧ����ʽ˵��)___________________��
��4����������Һ�м���NaOH ��Һ�۲쵽������Ϊ_______________________�������ɰ�ɫ��Ϊ���ɫ��ԭ����______________________________________(�û�ѧ����ʽ��ʾ)
��5��Ϊ�˵õ���ɫ��Fe(OH)2�������������ܿ��ܽϳ�ʱ�䱣�ְ�ɫ��������ͬѧ�������ͼ��ʾ��װ�ã������ʵ�����:______________________________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������500mL0.1mol/L CuSO4��Һ����ҪCuSO4��5H2O��������_____________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com