
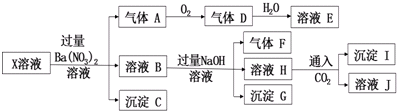
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
分析 pH=1的溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;沉淀G一定含有氢氧化铁,可能含有氢氧化镁,H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;不能确定是否含有的离子是Cl-,以此解答.
解答 解:A.A为NO,没有刺激性气味,故A错误;
B.由以上分析可知不一定含有Mg2+,故B错误;
C.沉淀I可能为氢氧化铝或在碳酸钡,可溶于硝酸,故C正确;
D.不能确定的阳离子为铝离子和镁离子,故D错误.
故选C.
点评 本题考查无机物推断,为高频考点,明确常见物质性质及状态是解本题关键,注意NO的特殊性质是推断A的关键,注意:亚硫酸盐能被硝酸氧化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 非金属性:甲<丙 | B. | 原子半径:乙<丁 | ||
| C. | 最外层电子数:乙<丙 | D. | 戊一定是硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
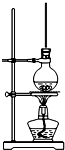 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 试 剂 | 分 离 方 法 | |
| A. | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
| B. | 硬脂酸钠(甘油) | 饱和食盐水 | 盐析后过滤 |
| C. | KNO3(KCl) | 水 | 蒸发结晶 |
| D. | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
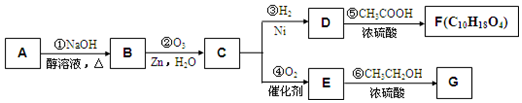
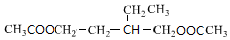 ,E
,E .
.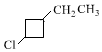 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$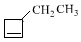 +NaBr+H2O,C→D
+NaBr+H2O,C→D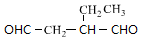 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$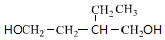 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作方法 |
| A | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 |
| B | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 |
| C | 除去Cl2中少量HCl | 将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com