

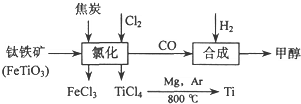
| ||
| ||
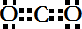 ,故答案为:
,故答案为: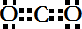 ;
;
| ||
| ||


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
| A、无色溶液中:K+、Na+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| C、由水电离出的c(OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D、能使甲基橙变黄色的溶液中:Na+、NO3-、S2-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
(1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏 | B、分液 | C、过滤 | D、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲基的电子式: | ||||
B、硫酸工业尾气中的SO2用过量的氨水吸收反应的离子方程式:NH3?H2O+SO2═NH
| ||||
C、4mol/LNaAlO2溶液与3.5mol/LH2SO4溶液等体积混合反应的离子方程式:4AlO
| ||||
| D、含有0.25mol Ba(OH)2的稀溶液与足量的稀盐酸反应,放出akJ的热量.则表示该反应中和热的热化学方程式是: Ba(OH)2(aq)+2HCl(aq)═BaCl2(aq)+2H2O(l);△H=-4akJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、以石墨为电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| B、NH4Cl水溶液显酸性:NH4++H2O═NH3?H2O+H+ | ||||
| C、AlCl3溶液中投入过量Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | ||||
| D、FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com