
| 10×80×(V2-V1)×10-3 |
| W |
| 80(V2-V1)c |
| W |
| 80(V2-V1)c |
| W |


科目:高中化学 来源: 题型:阅读理解
| 80(V2-V1)c |
| W |
| 80(V2-V1)c |
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:058
某校环保课外活动小组处理污水样品,需要配制250 mL 0.1 mol•L-1的标准盐酸溶液并做中和滴定实验。
(1)下图所示的仪器中,配制上述溶液肯定不需要用到的是 (填序号),除图中已有的仪器外,配制上述溶液还需要用到的玻璃仪器是 (填仪器名称)。

(2)用已知浓度的标准HCl溶液滴定未知浓度的NaOH溶液时,下列操作引起测定结果偏高的是(填序号) 。
A.滴定前仰视读滴定管刻度,滴定终点时俯视读滴定管刻度
B.滴定前锥形瓶中有5 mL蒸馏水
C.滴定前滴定管尖咀部分有气泡,而滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
(1)下图所示的仪器中,配制上述溶液肯定不需要用到的是 (填序号),除图中已有的仪器外,配制上述溶液还需要用到的玻璃仪器是 (填仪器名称)。
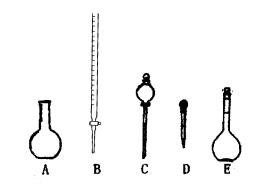
(2)用已知浓度的标准HCl溶液滴定未知浓度的NaOH溶液时,下列操作引起测定结果偏高的是(填序号) 。
A.滴定前仰视读滴定管刻度,滴定终点时俯视读滴定管刻度
B.滴定前锥形瓶中有5 mL蒸馏水
C.滴定前滴定管尖咀部分有气泡,而滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源:2012年海南省琼海市高考一模化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com