
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 12.0gNaHSO4固体中含有的阳离子数目为0.2NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
分析 A.氯气的所处的状态不明确;
B.过氧化钠与二氧化碳的反应为歧化反应;
C.硫酸氢钠固体中含有阳离子为钠离子;
D.过氧化钠由2个钠离子和1个过氧根构成.
解答 解:A.氯气的所处的状态不明确,故氯气的物质的量不一定是1mol,且氯气与铜反应时是得电子而非失电子,故A错误;
B.过氧化钠与二氧化碳的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故B正确;
C.12.0g NaHSO4固体物质的量为0.1mol,硫酸氢钠固体中含有阳离子为钠离子,固体中含有的阳离子数目为0.1NA,故C错误;
D.过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol即NA个阴离子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
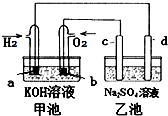 如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )
如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )| 甲池 | 乙池 | |
| A | 放电过程中KOH浓度不变 | 滴加酚酞试液d极区域溶液先变红 |
| B | OH-移向a电极 | OH-移向d电极 |
| C | a电极消耗2.24LH2时 (标准状况) | c电极生成1.12LO2 (标准状况) |
| D | a电极反应:H2-2e-=2H+ | d电极反应:4OH--4e-=O2↑+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度相等 | |
| C. | 容器内 X、Y、Z 的浓度之比为 1:2:2 | |
| D. | 单位时间消耗 0.1molX 同时生成 0.2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
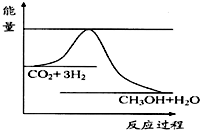 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
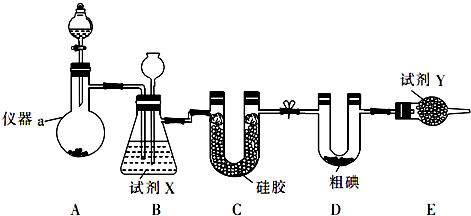
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
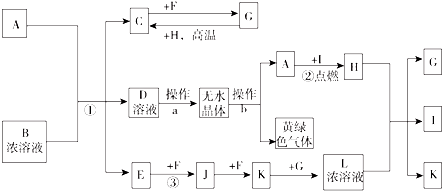
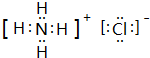 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
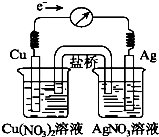 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com