
分析 (1)根据已知热化学方程式,利用盖斯定律计算和书写热化学方程式;
(2)①化学平衡的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③依据平衡常数概念写出该反应的平衡常数表达式,然后通过列式计算,依据浓度商和平衡常数比较分析判断;根据影响化学平衡的因素判断改变的条件;
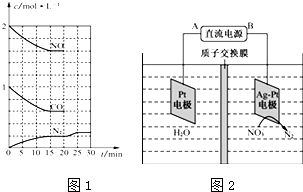
(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,Pt电极为阳极,A为正极,B为负极,以此解答该题.
解答 解:(1)由已知热化学方程式:
2 I2(s)+5O2(g)=2 I2O5(s);△H=-75.56kJ•mol-1①,
2CO(g)+O2(g)=2 CO2(g);△H=-566.0kJ•mol-1②,
根据盖斯定律将方程式②×$\frac{5}{2}$-①×$\frac{1}{2}$得5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=(-566.0kJ•mol-1)×$\frac{5}{2}$-(-75.56kJ•mol-1)×$\frac{1}{2}$=-1377.22kJ/mol,
所以其热化学反应方程式为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol,
故答案为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0
化学平衡的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
故答案为:$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,反应是气体体积减小的发热反应
a.反应前后气体体积减小,体系压强都保持不变,能用于判断是否达到平衡状态,故a正确;
b.混合气体的一无颜色,颜色保持不变,不能说明达到平衡状态,故b错误;
c.生成物N2和CO2的体积比始终保持不变,不能说明达到平衡状态,故c错误;
d.每生成1mol N2的同时生成2mol NO,说明正逆反应速率相同,能判断是否达到平衡状态,故d正确;
故答案为:ad;
③依据图象可知,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该温度下该反应的平衡常数为:K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{0.{6}^{2}×1.{6}^{2}}$=0.035,
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则各组分浓度分别为:c(NO)=1.6mol/L、c(CO)=0.6mol/L+0.6mol/L=1.2mol/L、c(N2)=0.2mol/L+0.6mol/L=0.8mol/L、c(CO2)=0.4mol/L,Qc=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.8×0.{4}^{2}}{1.6×1.{2}^{2}}$=0.035=K,则化学平衡不动,20min时,若改变反应条件,导致N2浓度发生如图所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:不;b;
(3)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A;2NO3-+10e-+12H+=6H2O+N2↑.
点评 本题考查了热化学方程式的书写方法,化学平衡的计算分析判断,原电池和电解池的原理的分析与计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3的水溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| B. | pH=3盐酸与pH=11氨水等体积混合时有:c(NH4+)=c(Cl-)>>c(H+)=c(OH-) | |
| C. | pH均为9的Na2CO3和CH3COONa溶液,二者的水解程度相同 | |
| D. | 在氨水中加水稀释,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
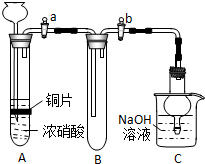 某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.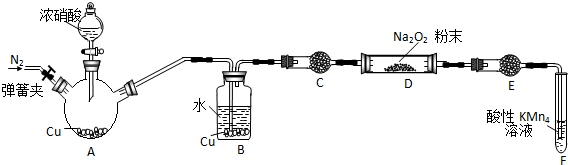
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤和天然气都是重要的化石燃料 | |
| B. | 淀粉、蔗糖和蛋白质均能发生水解反应 | |
| C. | 羊毛、塑料和橡胶均属于合成高分子材料 | |
| D. | 糖类、油脂和蛋白质都含有C、H、O三种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 医药中,常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性 | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com