
A是芳香烃的含氧衍生物。为了测定其分子组成,进行如下实验:
①在一定温度和压强下将A气化,其气体的质量是同温、同压下等体积氦气质量的38倍;②称取7.6gA,在11.2L氧气中完全燃烧,其产物只有CO2和水蒸气。将反应后的混合气 通过浓硫酸后体积为10.64L,浓H2SO4质量增加3.6g。再将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减少至6.16L(气体体积均在标准状况下测定)。试回答:
(1)A的分子式为 ;
(2)A物质苯环上只有一取代基,遇FeCl3溶液无显色反应。1molA只能与1molNaHCO3反应;1molA与足量Na反应生成1molH2。则A的结构简式为 ;
(3)A与足量钠反应的化学方程式是 。
【知识点】有机物的推断、有机方程式的书写
【答案解析】(1)C8H8O3(2)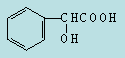
(3)
解析:(1)将A气化,其气体的质量是同温、同压下等体积氦气质量的38倍,A的相对分子质量为4×38=152,称取7.6gA,物质的量为:7.6g÷152g/mol=0.05mol,在11.2L(即0.5mol)氧气中完全燃烧,将反应后的混合气通过浓硫酸后体积为10.64L(0.475mol),是CO2或CO2与剩余O2的物质的量,浓H2SO4质量增加3.6g(水的质量),物质的量为0.2mol,将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减少至6.16L(0.275mol),这是氧气的量。设通入浓硫酸后的剩余气体中CO2的物质的量为x,O2的物质的量为y,
2CO2+2Na2O2=2Na2CO3+O2
x 1/2 x

 x+y=0.475 x=0.4mol
x+y=0.475 x=0.4mol
1/2 x+y=0.275 y=0.075mol
即0.05molA充分燃烧生成0.4molCO2和0.2molH2O,根据碳、氢原子守恒,A的分子式应该是
C8H8On,再根据相对分子质量求出n=3;故A分子式是C8H8O3;
(4)A物质苯环上只有一取代基,遇FeCl3溶液无显色反应,则不含酚羟基;1molA只能与1molNaHCO3反应,则含有羧基;1molA与足量Na反应生成1molH2,则A中含有一个羧基、一个羟基,则A的结构简式为 ;
;
(5)A与足量钠反应的化学方程式是:

【思路点拨】本题是有机物的推断,而计算含碳、氢量是本题的关键,还有根据性质推断官能团,有一定难度。


科目:高中化学 来源: 题型:
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,
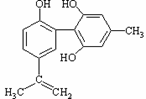
有关该物质的说法中正确的是( )
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C 三种元素的原子具有相同的电子层数;B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多5;1molA的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)写出下列元素名称:A__________,C__________。
(2)写出A、B最高价氧化物对应水化物分别与C的气态氢化物水溶液反应的离子方程式
、 。
(3)已知金属元素D和元素A、B在同一周期。分别向B,D最高价氧化物对应水化物中滴人A的最高价氧化物对应水化物的溶液,观察到的现象为
发生反应的化学方程式为__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是 、 ; D的结构简式是 。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是 。
(3)由苯酚生成A的化学方程式是 。
B与C反应的化学方程式是 。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成CO2和H2O。则F的分子式是 。
已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有机物A是链状化合物,分子内只含有两种官能团,A和一些化学试剂的反应情况如下图所示:
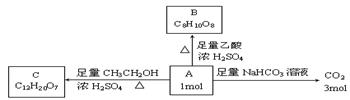
请回答下列问题:
(1)A分子内含有的两种官能团是(写名称) 。
(2)核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 。
(3)由A生成B的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
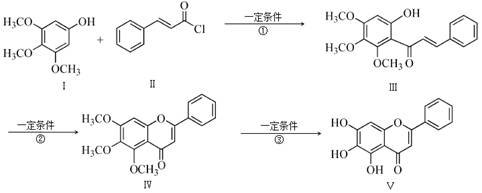
回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2.
(2)化合物Ⅱ的合成方法为:
|
 -CHO+(CH3CO)2O →
-CHO+(CH3CO)2O →
 -CH=CHCOOH+ A
-CH=CHCOOH+ A
 |
|

 -CH=CHCOOH 化合物Ⅱ
-CH=CHCOOH 化合物Ⅱ 已知在合成肉桂酸的化学反应中,反应物的物质的量之比为1︰1,生成物A可与饱和NaHCO3溶液反应产生气体,则生成物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为 。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是 (填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示紫色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com