
 元素周期表中,金属和非金属分界线附近的元素性质特殊.其单质和化合物应用广
元素周期表中,金属和非金属分界线附近的元素性质特殊.其单质和化合物应用广3- 4 |
| 2098 |
| N A |
| ||
| a3×10- 30cm3 |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
| A、阿伏加德罗常数的数值近似为6.02×1023 |
| B、阿伏加德常数个微粒的物质的量是1mol |
| C、1mol 12C原子的质量为12g |
| D、硫酸的摩尔质量是98克 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入稀有气体使压强增大,平衡将逆向移动 |
| B、C的正反应速率是A的逆反应速率的3倍 |
| C、降低温度,混合气体的平均相对分子质量减小 |
| D、移走部分C,C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池反应中MnO2起催化作用 |
| B、该电池的正极反应为:MnO2-e-+H2O═MnO(OH)+OH- |
| C、导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D、电池工作时,负极周围溶液的pH将不断变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、在常温常压下,11.2 L Cl2含有的分子数为0.5 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示反应X(g)+Y(g)?Z(g);△H<0,从时间0~t3s的变化,则t2~t3时间段的变化是由下列哪项条件的改变引起的( )
如图表示反应X(g)+Y(g)?Z(g);△H<0,从时间0~t3s的变化,则t2~t3时间段的变化是由下列哪项条件的改变引起的( )| A、升高温度 |
| B、迅速缩小容器体积 |
| C、增大X的浓度 |
| D、增大Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
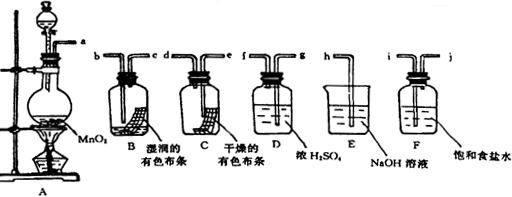
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com