
分析 0.1mol•L-1的CH3COONH4中性溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-,
NH4++H2O?NH3•H2O+H+,
H2O?OH-+H+,
①根据溶液中存在的三个平衡来分析;
②根据溶液显中性且盐类的水解程度不大来分析;
③CH3COO-部分水解为CH3COOH,NH4+部分水解为NH3•H2O,据此分析.
解答 解:0.1mol•L-1的CH3COONH4中性溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-
NH4++H2O?NH3•H2O+H+
H2O?OH-+H+
①溶液中的粒子有:CH3COO-、NH4+、CH3COOH、NH3•H2O、H+、OH-、H2O,故答案为:CH3COO-、NH4+、CH3COOH、NH3•H2O、H+、OH-、H2O;
②由于溶液显中性,即有c(H+)=c(OH-),根据溶液的电中性可知c(CH3COO-)=c(NH4+),由于盐类的水解程度很小,故水解出的离子的H+、OH-浓度很小,小于未水解的CH3COO-、NH4+浓度,故有浓度关系为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),故答案为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
③0.1mol•L-1的CH3COONH4中性溶液中,CH3COO-部分水解为CH3COOH,NH4+部分水解为NH3•H2O,根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3•H2O)=0.1mol/L,故答案为:(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3•H2O)=0.1mol/L.
点评 本题考查了在盐溶液中的粒子种类的判断以及电荷守恒、物料守恒的运用,难度不大,注意掌握基础.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
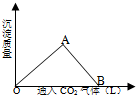 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO4 2-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Ba2+、Cl-、K+、SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2 溶液 | B. | AgNO3 溶液 | C. | Ba(OH)2 溶液 | D. | NaOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上炼铁的原料是赤铁矿 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 | |
| D. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com