
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
分析 Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=$\frac{n}{V}$计算盐酸的浓度.
解答 解:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸盐酸可能有剩余,
向反应后溶液中加入NaOH溶液,得到的沉淀最多,应满足恰好反应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,
根据钠离子守恒可得:n(NaCl)=n(NaOH)=0.25L×2.0mol/L=0.5mol,
根据氯离子守恒可得:n(HCl)=n(NaCl)=0.5mol,
故该元素的物质的量浓度为$\frac{0.5mol}{0.5L}$=1mol/L,
故选B.
点评 本题考查混合物的计算,为高频考点,把握沉淀最多时溶液的溶质及守恒法为解答本题的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1mol•L-1 | |
| B. | 等物质的量浓度的Na2CO3溶液与NaHCO3溶液相比,前者的c(H+)更小 | |
| C. | pH=9.4,浓度均为0.1mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
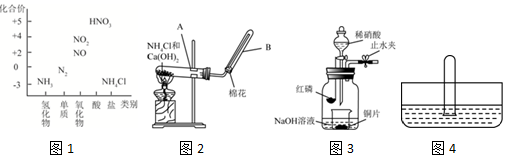
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温时压强不再改变的状态 | |
| B. | 体系温度不在改变的状态 | |
| C. | 恒温时混合气体的密度不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
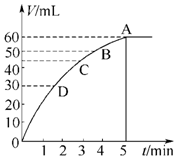
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 铝片放在不密封的容器里 | |
| C. | 硫酸亚铁溶液保存在加有少量铁粉的试剂瓶中 | |
| D. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 操作 | 现象 |
| A | 滴有酚酞的明矾溶液 | 加热 | 颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NH4NO3固体 | 颜色变浅 |
| D | 氯化铁溶液 | 加热 | 颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com