
 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.
| ||
| ||
| 0.05mol×106g/mol |
| 17.90g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入过量的氨水:Fe3++3OH-→Fe(OH)3↓ |
| B、AlCl3溶液中加入过量的氨水:Al3++3NH3?H2O=Al (OH)3↓+3NH4+ |
| C、铁与稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| D、氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②⑤ |
| C、②③⑤ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
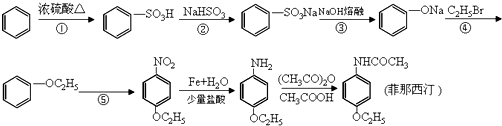
查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
查看答案和解析>>
科目:高中化学 来源: 题型:
 是合成某些药物的中间体.试设计合理方案由化合物
是合成某些药物的中间体.试设计合理方案由化合物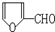 合成
合成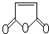 .
.| HBr |
| NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL)[ | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com