
| 0.96 |
| M |
| 0.896 |
| 22.4 |
| 0.96 |
| M |
| 0.896 |
| 22.4 |
| 0.96g |
| 24g/mol |
| 0.56g |
| 28g/mol |
| ||
| △ |
| 0.448L |
| 22.4L/mol |
| ||
| △ |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、使石蕊试液变红的溶液:Na+、K+、NO
| ||||
B、常温下,由水电离出的c(H+)=10-14mo1?L-1的溶液:K+、Na+、HCO
| ||||
C、与铝反应放出氢气的溶液:K+、A13+、SO
| ||||
D、含有大量Fe3+的溶液:Na+、Mg2+、NO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
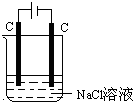 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D在周期表中的位置如图1所示,B、D最外层电子数之和为12,二者可形成DB2、D
短周期元素A、B、C、D在周期表中的位置如图1所示,B、D最外层电子数之和为12,二者可形成DB2、D| B | 3 |
| H | 2 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol?L-1 HCl溶液 | 沉淀溶解 |
| Ⅱ | 4mL 2mol?L-1 NH4Cl溶液 | 沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时负极附近溶液的pH不变 |
| B、放电时电解质溶液中的OH-向正极移动 |
| C、充电时电池的负极应与电源的负极相连接 |
| D、充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com