
分析 (1)依据热化学方程式和盖斯定律计算所需让化学方程式计算得到蒸发45g液态水需吸收的热量;
(2)依据燃烧热的定义解答,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
解答 解:(1)①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1,
依据盖斯定律计算①-②×2得到:2H2O(l)═2H2O(g)△H=88kJ/mol,
蒸发45g液态水物质的量为:$\frac{45g}{18g/mol}$=2.5mol,需吸收的热量为:2.5mol×44KJ/mol=110kJ,
故答案为:110;
(2)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则1mol乙醇(质量为46g)完全燃烧生成稳定的氧化物放出的热量为:46×29.713kJ=1366.8kJ,
乙醇燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ•mol-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ•mol-1.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的书写原则,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag + | B. | NO ${\;}_{3}^{-}$ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体加入稀盐酸,产生了无色气体,证明该固体一定是碳酸盐 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
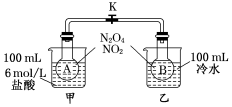 为测定温度对平衡的影响,设计了如下试验.
为测定温度对平衡的影响,设计了如下试验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com