
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
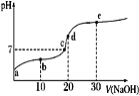
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
科目:高中化学 来源: 题型:
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
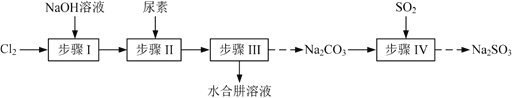
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
随pH的分布如题图2所示,Na2SO3的溶解度曲线如题图3所示)。
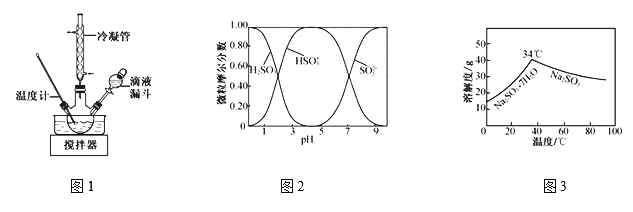
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装(结合图2、图3说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z都是元素周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物;
②Y 和Z属同族元素,他们能形成两种常见化合物;
③X和Z属同一周期元素,他们能形成两种气态化合物;
④W和Z能形成组成为W2Z和W2Z2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。请回答:
(1)Y元素名称是___________;
(2)用一方程式证明Y与X非金属性的强弱__________,证明Y与Z非金属性的强弱_____________。
(3)标准状况22.4LXZ2和通过足量的W2Z2时,转移的电子数是____,W2Z2的质量将增加______g
(4)观察W元素的焰色的操作注意事项__________________________
(5)上述某元素形成的分子式为C8H10的属于苯的同系物的同分异构体有______________ 种。其中,苯环上的一氯代物种类最多的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 == K2O+5X+16N2↑,下列说法不正确的是
A. X的化学式为Na2O
B. 每生成1.6molN2,则转移的电子为3 mol
C. 若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol
D. 上述反应中NaN3被氧化,KNO3发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com