
反应3H2(g) + N2(g) 2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是( )
2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是( )
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
科目:高中化学 来源: 题型:
(10分)某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)由表中所列化学键所形成的分子中,最稳定的是 ,最不稳定的是 。
(3)由键能数据计算可以算出反应3H2(g)+N2(g)=2NH3(g)的反应热△H=__________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省罗源县第一中学高二下学期第一次月考化学试卷 题型:填空题
(10分)某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三下学期一调考试理综化学试卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)? △H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚; 2CH3OH  CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚: 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)?? △H=-247kJ/mol
CH3OCH3(g)+CO2(g)?? △H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:
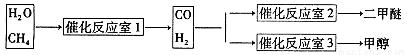
(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数)????????????????????????????????????????????????
(2)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是?????
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是?????
A.低温高压?? B.加催化剂??? C.增加CO浓度?? D.分离出二甲醚
(3)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g)? △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是??? (填序号)
CH3OH(g)+H2O (g)? △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是??? (填序号)
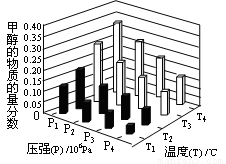
A.P3>P2?? T3>T2?????? B.P2>P4?? T4>T2
C.P1>P3 ? T1>T3?????? D.P1>P4?? T2>T3
(4)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)? △H>0写出平衡常数的表达式:??????????????????????????
CO(g)+3H2(g)? △H>0写出平衡常数的表达式:??????????????????????????
如果温度降低,该反应的平衡常数????????????? (填“不变”、“变大”、“变小”)
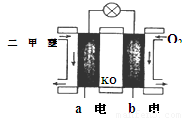
(5)如图为绿色电源“二甲醚燃料电池”的工作原理示意图则a电极的反应式为:________________
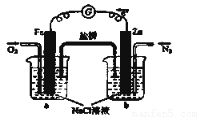
(6)下列判断中正确的是_______
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H+ + 4eˉ = 2H2O,溶液pH降低
查看答案和解析>>
科目:高中化学 来源:浙江省临海市2009-2010学年度高二下学期第一次月考化学试题 题型:选择题
下列说法正确的是 ( )
(1)增加水的量或温度,可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)  CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)  2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)  2NH3(g),使用正催化剂,正逆反应速率同等程度加快。
2NH3(g),使用正催化剂,正逆反应速率同等程度加快。
A.(1)(2) B.(1)(2)(3) C.(1)(2)(3)(4) D.(5)
查看答案和解析>>
科目:高中化学 来源:2012届湖北省高二上学期期末考试化学试卷 题型:选择题
反应3H2(g)
+ N2(g) 2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是(
)
2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是(
)
A.随温度升高K增加 B.随压强升高K增加
C.随温度升高K减小 D.随压强升高K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com