
分析 硫酸铝为强电解质,在水中完全电离,电离方程式:Al2 (SO4)3═2Al3++3SO42-,依据n=CV计算硫酸铝的物质的量,结合电离方程式计算铝离子、硫酸根离子的物质的量,再计算阴阳离子总数,依据C=$\frac{n}{V}$计算蔗糖的物质的量浓度.
解答 解:100mL 1mol•L-1Al2(SO4)3溶液中,含硫酸的铝的物质的量为:1mol•L-1×0.1L=0.1mol,硫酸铝为强电解质,在水中完全电离,电离方程式:Al2 (SO4)3═2Al3++3SO42-,
则:Al2 (SO4)3═2Al3++3SO42-,
1 2 3
0.1mol n(Al3+) n(SO42-)
所以:n(Al3+)=0.2mol;
n(SO42-)=0.3mol;
溶液中阴阳离子总数:0.2+0.3=0.5mol,
蔗糖的物质的量浓度C=$\frac{n}{V}$=$\frac{0.5mol}{0.1L}$=5mol/L;
故答案为:0.2;0.3;5.
点评 本题考查了电解质的电离及有关物质的量浓度计算,明确电解质强弱、物质的量浓度概念是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 Br2 Fe3+ Cu2+ | B. | 浓H2SO4 Cu2+Fe3+ Br2 | ||
| C. | Br2 浓H2SO4 Fe3+Cu2+ | D. | Fe3+ Cu2+ Br2 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料制品可用于食品的包装 | |
| B. | 利用碳酸酯聚合材料生产一次性饭盒可以减少对环境产生的白色污染 | |
| C. | 汽车尾气中的NO、CO等是汽油和柴油的不完全燃烧产物 | |
| D. | 部分烷烃常用于家庭烹饪的燃料气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

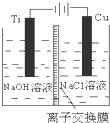
| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 放电时,交换膜右侧中有大量白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 实验②放置一段时间后,小试管内有晶体析出 | |
| C. | 实验③振荡后静置,上层溶液颜色变浅 | |
| D. | 实验④可用于分离饱和Na2CO3溶液和CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com