
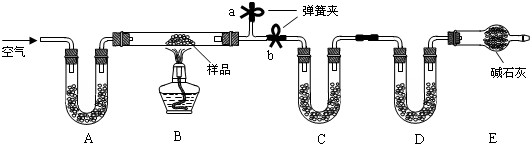
| ||
| ||
| 168×m2g |
| 44 |
| 42m2 |
| 11 |
| ||
| w |
| 42m2 |
| 11w |
| 42m2 |
| 11w |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
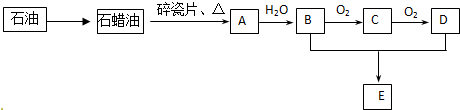
查看答案和解析>>
科目:高中化学 来源: 题型:
A、可用酸性高锰酸钾溶液检验 中的醛基 中的醛基 |
| B、可用新制的银氨溶液鉴别乙酸甲酯和乙醛 |
| C、能用一种试剂区分葡萄糖溶液、甘油、醋酸福尔马林等4种溶液 |
| D、1-戊炔和裂化汽油都能是溴水褪色,且褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若反应符合图象Ⅰ且p2>p1,则a+b>c |
| B、若反应符合图象Ⅱ,则此反应的△H<0,且T1>T2 |
| C、若反应符合图象Ⅲ且T1<T2,则a+b=c,且△H<0 |
| D、在其他不变的情况下,使用催化剂,可以改变反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 C(s)、CO(g)、H2(g)的燃烧烧(单位:kJ?mol-1)分别是-393.5、-283.0、-285.8.
C(s)、CO(g)、H2(g)的燃烧烧(单位:kJ?mol-1)分别是-393.5、-283.0、-285.8.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的体积分数变大 |
| D、a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,2一二甲基丁烷 |
| B、邻二甲苯 |
| C、2-甲基丁烷 |
| D、正戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有AgCl析出 |
| B、无AgCl析出 |
| C、溶液c(Ag+)=c(Cl-) |
| D、溶液c(Ag+)<c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com