
【题目】将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,A和B浓度比c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin).
(1)A在5min末的浓度是多少?
(2)B的平均反应速率是多少?
(3)D的平均反应速率是多少?
(4)x值是多少?
【答案】
(1)解:D的浓度为0.5mol/L,所以D的物质的量为1mol.
3A(g)+B(g)=xC(g)+2D(g),
开始:n mol n mol 0 0
反应:1.5mol 0.5mol 1mol
5min:(n﹣1.5)mol ( n﹣0.5)mol 1mol
c(A):c(B)= ![]() :
: ![]() =3:5,
=3:5,
所以n=3,
有以上分析可知开始时A,B的物质的量都为3mol,则A在5min末的浓度是 ![]() mol/L=0.75mol/L;
mol/L=0.75mol/L;
答:A在5min末的浓度是0.75mol/L
(2)解:反应速率之比等于化学计量数之比,x=2,则v(B)= ![]() v(C)=
v(C)= ![]() ×0.1mol(Lmin)﹣1=0.05mol(Lmin)﹣1,
×0.1mol(Lmin)﹣1=0.05mol(Lmin)﹣1,
答:B的平均反应速率为0.05mol(Lmin)﹣1
(3)解:D的浓度为0.5mol/L,反应时间为5min,D的反应速率为0.1molL﹣1min﹣1,
答:D的平均反应速率为0.1mol(Lmin)﹣1
(4)解:D的浓度为0.5mol/L,反应时间为5min,D的反应速率为0.1molL﹣1min﹣1,C的反应速率是0.1molL﹣1min﹣1,根据同一反应中,各物质的反应速率之比等于计量数之比,所以x=2,
答:X的值为2
【解析】利用三段式法解答,先设A、B的物质的量为nmol;
D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始:n mol n mol 0 0
反应:1.5mol 0.5mol 1mol
5min:(n﹣1.5)mol ( n﹣0.5)mol 1mol
c(A):c(B)= ![]() :
: ![]() =3:5,
=3:5,
所以n=3,
再根据物质的量浓度公式计算浓度;
根据D的浓度求出D的反应速率,C、D反应速率之比即为计量数之比;
根据C的反应速率求B的反应速率.


科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,FeS的Ksp=6.25×10﹣18(设饱和溶液的目睹为1g/mL),若已知H2S饱和溶液在常温下,c(H+)与c(S2﹣)之间存在以下关系:c2(H+)c(S2﹣)=1.0×10﹣22 , 该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正)(填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.碳的摩尔质量为12gB.1molH2O的质量是18g·mol-1
C.CO2的相对分子质量是44D.标况下气体的摩尔体积为22.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.Na2SO4=2Na++SO42-B.FeCl3=Fe2++3C1-
C.Ba(OH)2=Ba2++(OH)22-D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的△H=+100kJmol﹣1 , 下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJmol﹣1
B.逆反应活化能一定小于100 kJmol﹣1
C.正反应活化能不小于100 kJmol﹣1
D.正反应活化能比逆反应活化能小100 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成(部分反应条件略去):
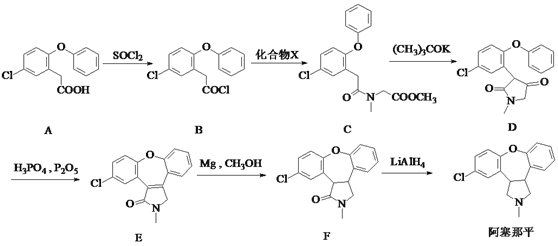
(1)阿塞那平中的含氧官能团为______________(填官能团的名称)。由F→阿塞那平的反应类型为____________。
(2)化合物X的分子式为C4H9NO2,则由B→C反应的另一产物的化学式___________。
(3)由D生成E的过程中先后发生加成反应和消去反应,则加成反应后中间体的结构简式为 ________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___________。
Ⅰ.属于芳香化合物,分子中含有酯基且只有5种不同化学环境的氢;
Ⅱ.能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(5)已知:![]() ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和![]() 为原料制备
为原料制备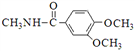 的合成路线流程图(无机试剂任用)。合成路线流程图示例如:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如:![]() _________________
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆呈浅灰色的多价稀有金属,性质很稳定,且耐腐蚀性很强。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是
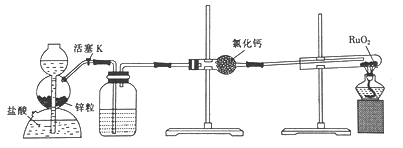
A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去HCl
C. 结束反应时,先停止加热,再关闭活塞K
D. 启普发生器也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com