
����Ŀ��(1)3.01��1023��NH4+�������ӵ����ʵ�����______mol�����е��ӵ����ʵ�����______mol��
(2)200mL 2mol/L��Al2(SO4)3 ��Һ��SO42-�����ʵ���Ũ��Ϊ_________��
(3)��״����36g H2��O2��ɵĻ������������67.2L �������ֻ��������H2��O2�������Ϊ____________��
(4)ͬ��ͬѹ�£�������Ϊ17��48��NH3��CH4�������壬�ܶ�֮��Ϊ_________��
(5)��֪1.505��1023��A�����������Ϊ31g ����A�����Ħ��������_________��
���𰸡�5.5mol 5mol 6mol 2:1 3:1 128g/mol
��������
(1)���ӵ����ʵ���n=![]() �����һ�������е����������������������ӵ����ʵ��������������õ����ӵ����ʵ��������ӵ����ʵ������Ե������õ����ӵ����ʵ�����
�����һ�������е����������������������ӵ����ʵ��������������õ����ӵ����ʵ��������ӵ����ʵ������Ե������õ����ӵ����ʵ�����
(2)Al2 (SO4)3���������Ũ�ȵ���Al2 (SO4)3��Ũ�ȳ���3��
(3)��״����36g H2��O2��ɵĻ������������67.2L��������������Եõ������ʵ����������������������ʵ����г���Ԫһ�η��̣����Եõ����ʵ���֮�ȣ��������������֮�ȵ������ʵ���֮�ȵõ��𰸣�
(4)ͬ��ͬѹ�£� NH3��CH4����������ܶ�֮�ȵ�����Է�������֮�ȣ����Եõ��𰸣�
(5)����n=![]() ������ʵ���n=
������ʵ���n=![]() ��M=
��M=![]() ��
��
(1)n(NH4+)=![]() =
=![]() =0.5mol��һ��NH4+����11�����ӣ�10�����ӣ������������ʵ���Ϊ0.5mol��11=5.5mol�����е������ʵ���Ϊ0.5mol��10=5mol��
=0.5mol��һ��NH4+����11�����ӣ�10�����ӣ������������ʵ���Ϊ0.5mol��11=5.5mol�����е������ʵ���Ϊ0.5mol��10=5mol��
(2). 200mL 2mol/L��Al2 (SO4)3 ��Һ��SO42-�����ʵ���Ũ�ȵ���2mol/L��3=6 mol/L��
(3)��״����36gH2��O2��ɵĻ������������67.2L��������������ʵ���=![]() =3mol�������������ʵ���Ϊx�����������ʵ���Ϊy���� x+y=3��2x+32y=36�����x=2��y=1������£���������ʵ���֮�ȵ������֮�ȵ���2:1��
=3mol�������������ʵ���Ϊx�����������ʵ���Ϊy���� x+y=3��2x+32y=36�����x=2��y=1������£���������ʵ���֮�ȵ������֮�ȵ���2:1��
(4)ͬ��ͬѹ�£�NH3��CH4����������ܶ�֮�ȵ�����Է�������֮��17:16��
(5)n(A)=![]() =
=![]() =0.25mol����A�����ʵ���n=
=0.25mol����A�����ʵ���n=![]() ��M=
��M=![]() =
=![]() =128g/mol��
=128g/mol��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�Ļ��������п��ܺ���NO2��NO��CO2��O2��NH3��N2�еļ��֣���100mL�����徭����ͼ��ʾ��ʵ��װ�ý��д���������õ�������Һ��������������ʣ�࣬�����������Ϊ(������Na2O2��NO2��NO�ķ�Ӧ)�� ��
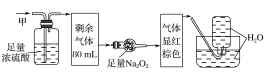
A.NO2��CO2��N2B.NH3��NO��CO2
C.NH3��N2��CO2D.NO��O2��NH3
���𰸡�B
��������
��������ɫ��˵�����в���NO2������ͨ��Ũ���������С��˵��������NH3������ͨ������Na2O2���Ժ���ɫ��˵�����к���CO2��NO���ʲ���O2�����ͨ��ˮ��������ʣ�࣬˵�����в�����N2��ѡ��B��ȷ���ʴ�ΪB��
�����͡���ѡ��
��������
19
����Ŀ��A��B��C��D�����ֳ������嵥�ʡ�E����Է���������FС16����FΪ����ɫ���йص�ת����ϵ��ͼ��ʾ(��Ӧ�����벿�ַ�Ӧ����������ȥ)��
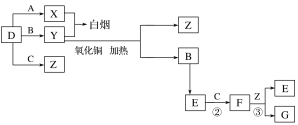
��ش��������⣺
��1��D�Ļ�ѧʽΪ__��Y�Ļ�ѧʽΪ__��E�Ļ�ѧʽΪ__��
��2��Y������ͭ��Ӧ��ÿ����1molB����3mol����ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��3��Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
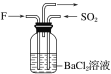
��4������F������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ��(��ͼ��ʾ)��ϴ��ƿ���Ƿ��г������ɣ�__��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý���ʵ�飬��д�й�����ѧ����ʽ��
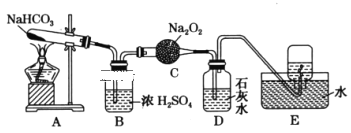
��1��A��������___��
��2��B��Ũ�����������___��
��3��C�з�����Ӧ�Ļ�ѧ����ʽΪ___��
��4��D�е�������___��������Ӧ�����ӷ���ʽ��___��
��5��E���ռ���������___�������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2����Fe3����Al3����Ba2����NH4+��CO32-��NO3-��SO42-��SiO32-�е������֣���ȡX��Һ��������ʵ�飬ʵ����̼�������ͼ��ʾ��ʵ���������һ������Ϊ����ɫ��
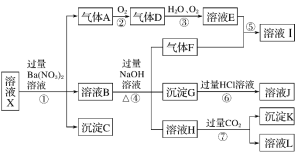
����������Ϣ���ش��������⣺
(1)��ǿ�������������ж�X��Һ�п϶������ڵ�������________
(2)��ҺX�й�����������ӵ��жϣ���ȷ����______(���ţ���ͬ)��
a��һ������ ��b��һ�������� ������c�����ܺ���
(3)������I�к��еĻ�ѧ��������____________
(4)ת���ߵ����ӷ���ʽΪ____________
(5)�Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������________��
��NaOH��Һ����KSCN��Һ������ˮ��KSCN�Ļ����Һ����pH��ֽ����KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���ѡ����ȷ���� �� ��
A.  X��Ϊ��������������NH3��HCl������ֹ����
X��Ϊ��������������NH3��HCl������ֹ����
B. 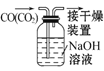 ��ȥCO�е�CO2
��ȥCO�е�CO2
C.  �����ڷ���C2H5OH��H2O�Ļ����
�����ڷ���C2H5OH��H2O�Ļ����
D. 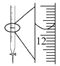 ��¼�ζ��յ����Ϊ12.20 mL
��¼�ζ��յ����Ϊ12.20 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4������Fe��Al�������Ϊԭ���Ʊ�MgCO3��3H2O��ʵ��������磺
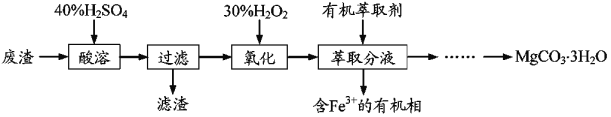
��1�����ܹ�������Ҫ��Ӧ���Ȼ�ѧ����ʽΪ
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ��H=-50.4kJ��mol�C1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ��H=-225.4kJ��mol�C1
��������ȵ�Ŀ����__������H2SO4���˹���̫���ԭ����__��
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ__��
��3������ͼ��ʾ��ʵ��װ�ý�����ȡ��Һ���Գ�ȥ��Һ�е�Fe3+��
��ʵ��װ��ͼ������A������Ϊ__��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ��ˮ��Һ������A�м���һ�������л���ȡ����__�����á���Һ�����ظ���Ρ�
��4���벹����������ȡ��õ���ˮ��Һ�Ʊ�MgCO3��3H2O��ʵ�鷽�����߽��������Һ�еμӰ�ˮ��___�����ˡ���ˮϴ�ӹ���2��3�Σ���50���¸���õ�MgCO3��3H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���25��m������������)������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش���������:
��1��PM2.5��ɢ�ڿ������γɵķ�ɢϵ___(����������,����������)���塣
��2����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±�:
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��(mol/L) | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������жϴ�������Ϊ___(��������������)��,��ʾ����������Ե�c(H+)��c(OH-)=_______mol/L��
��3��úȼ���ŷŵ���������SO2��NOx���γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
___ClO2-+__NO+____=___Cl-+___NO3-+___��________________
��4��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ��:
����úת��Ϊ�������ȼ�ϡ�д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ___________��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ�����___________��
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��5������β����NOx��CO�����ɼ�ת����
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��д������������NO��ѧ����ʽ_______________��
������ȼ�Ͳ���ȫȼ��ʱ����CO��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ���������ǣ�������
A. ��ɫ������Һ�У�Fe3+��Mg2+��SCN����Cl��
B. ![]() ��1��10��12����Һ�У�K+��Na+��CO32����NO3��
��1��10��12����Һ�У�K+��Na+��CO32����NO3��
C. ������Һ�У�Na+��ClO����SO42����I��
D. ���ܽ�Al2O3����Һ�У�Na+��Fe2+��HS����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(KIO3)��һ�ְ�ɫ����ɫ���壬������ˮ�����н�ǿ�������ԡ���������ʳ�������Է��ε�ȱ��������֪��ij��Ӧ��ϵ�д������¼������ʣ� KIO3��K2SO4��KI��I2��H2SO4��H2O��
��1��д��������Ӧ�Ļ�ѧ����ʽ_________��
��2������˵������ȷ����_____��
A��I2�Ƿǵ���� B��K2SO4��Һ�ĵ���������KI��Һ��ǿ
C��H2SO4��Һ�ڸ÷�Ӧ������������ D��KIO3�������������л�ԭ��
��������(ClO2)�Ǹ�Ч��ȫ������ˮ���������õ�Խ��Խ�㷺��Ӧ�ã�ʵ���ҿ���KClO3ͨ�����·�Ӧ�Ƶã�2KClO3��H2C2O4��H2SO4===2ClO2����K2SO4��2CO2����2H2O���Իش��������⡣
��3���÷�Ӧ�л�ԭ����Ļ�ѧʽ��_____����������Ԫ����______��
��4���õ����ű��������Ӧ�ĵ���ת�����____2KClO3��H2C2O4��H2SO4 == 2ClO2����K2SO4��2CO2����2H2O
��5��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN ��ӦΪ�������ʣ�������Ӧ�������Cl���˹���˵��ClO2��Cl2������__ (����������������ԭ��)�ԡ���������ͬ��CN�ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��___����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com