
【题目】如图是甲醇燃料电池的构造示意图,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列有关该电池的说法不正确的是( )
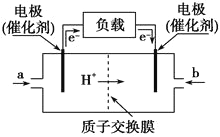
A.等量的甲醇通过燃料电池释放的电能比其通过火力发电产生的电能多
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+
D.若用池电池电解足量饱和食盐水(石墨电极),消耗1mol甲醇时,产生标况下44.8L氢气
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)乙烯的电子式为______________;
(2)当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成
2,2-二甲基丁烷,则A的结构简式为______________________________。
(3)某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2反应,则该烃的结构简式为______________________。
(4)相对分子质量为72且沸点最低的烷烃的结构简式_______________________;
(5)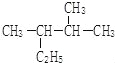 的名称(系统命名法)_______________________。
的名称(系统命名法)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
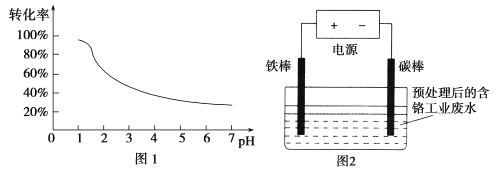
有关数据如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 |
开始沉淀的pH | 1.9 | 7.5 | 4.3 |
完全沉淀的pH | 3.4 | 9.7 | 7.6 |
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是 。
(2)电解过程中阳极质量减小,阴极有气体产生,写出两极的电极反应式:
阳极 ,阴极 。
(3)写出Cr2O72-转化为Cr3+的离子方程式: 。
(4)每处理1molCr2O72-,外电路中转移 mol电子。
(5)电解过程中解液的pH (填增大、减小或不变)
(6)处理过程中,当废水颜色不再发生明显变化时,切断电源,取出电极。此时,溶液中的阳离子有Fe2+、Fe3+、Cr3+,若想用调节pH的方法得到纯净的Cr(OH)3沉淀,应先向溶液中加入适量的 ,再调节pH= ,过滤后继续调节pH= 8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液酸度:AG = lg![]() 。在室温下,用0.1 mol/L的HCl溶液滴定20.00mL0.1mol/L氨水。滴定结果可表示如下图: 下列分析正确的是
。在室温下,用0.1 mol/L的HCl溶液滴定20.00mL0.1mol/L氨水。滴定结果可表示如下图: 下列分析正确的是
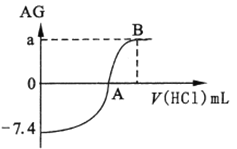
A. 0. lmol/L 氨水 pH = 10.2
B. A点加入盐酸的体积为20. 00mL
C. 若a=7,从A到B水的电离程度逐渐减小
D. B点溶液中可能存在c(Cl-)>c(NH4+ )>(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中均伴有颜色的变化,与其他颜色褪色原理不同的是( )
A.臭氧使有色布条褪色
B.SO2使品红溶液褪色
C.氯气使鲜花褪色
D.过氧化钠使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3和Cu(NO3)2的混合溶液200mL,其中c(NO3-)=2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况),假设电解后溶液体积不变,下列说法正确的是( )
A.原混合溶液中c(K+)=0.5mol·L-1
B.电解得到的Cu的物质的量为0.2mol
C.上述电解过程中共转移0.4mol电子
D.电解后溶液中c(H+)=2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com