


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g)====2H2O(g) ΔH=-Q2 kJ·mol-1; 2H2(g)+O2(g)====2H2O(l) ΔH=-Q1 kJ·mol-1 |
| B.S(g)+O2(g)====SO2(g) ΔH=-Q1 kJ·mol-1; S(s)+O2(g)====SO2(g) ΔH=-Q2 kJ·mol-1 |
C.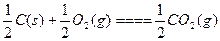 ΔH=-Q1 kJ·mol-1; ΔH=-Q1 kJ·mol-1;C(s)+O2(g)====CO2(g) ΔH=-Q2 kJ·mol-1 |
| D.H2(g)+Cl2(g)====2HCl(g) ΔH=-Q1 kJ·mol-1; |
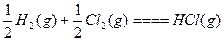 ΔH=-Q2 kJ·mol
ΔH=-Q2 kJ·mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由单质A转化为单质B,△H=+119kJ/mol,可知单质B比单质A稳定 |
| C.稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 |
| B.凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式 |
| D.氢气在氧气中燃烧的热化学方程式是:2H2(g)+O2(g)═2H2O(l);△H=-483.6kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何一个化学变化的过程中都包含着能量的变化 |
| B.化学变化过程中能量变化的实质就是旧键断裂要吸收能量,新键生成会放出能量 |
| C.如果生成物的能量比反应物的能量高,则该反应为放热反应 |
| D.如不特别注明,化学反应的反应热就是就是该反应的焓变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )| A.vA==0.15mol/(L·min) | B.vB="=0.6" mol/(L·min) |
| C.vC="=0.4" mol/(L·min) | D.vD="=0.01" mol/(L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com