
���� ��1���ֱܷ������������������Һ��Ӧ���������Ľ���ΪAl��
��2��Ũ���������ˮ�Ժ���ˮ�ԣ�
��3���������ƿ���ˮ��������̼��Ӧ����������
��4����ʹʪ��ĺ�ɫʯ����ֽ����������Ϊ�������壮
��� �⣺��1���ֱܷ������������������Һ��Ӧ���������Ľ���ΪAl���ʴ�Ϊ��B��
��2��Ũ���������ˮ�Ժ���ˮ�ԣ�ֽ�ű�ڣ�˵��Ũ������е���������ˮ�ԣ��ʴ�Ϊ��C��
��3���������ƿ���ˮ��������̼��Ӧ�����������ʴ�Ϊ��A��
��4����ʹʪ��ĺ�ɫʯ����ֽ����������Ϊ�������壬Ϊ�������ʴ�Ϊ��D��
���� �����ۺϿ���Ԫ�ػ�����֪ʶ��Ϊ��Ƶ���㣬������ѧ���ķ��������Լ�Ԫ�ػ�����֪ʶ���ۺ���������ã��ѶȲ���ע����ػ���֪ʶ�Ļ��ۣ�


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǻ��ĵ���ʽ�� | B�� | ������ӵı���ģ�ͣ� | ||
| C�� | 1��3-����ϩ�ķ���ʽ��C4H8 | D�� | ��������Ľṹ��ʽ��C2H4O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
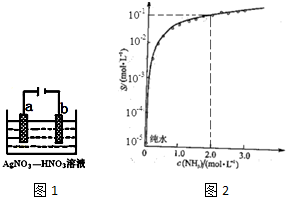
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
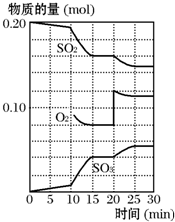 ��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܶȱ�Ϊ1��1 | B�� | �ܶȱ�Ϊ11��16 | C�� | �����Ϊ16��11 | D�� | �����Ϊ11��16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͨ��ˮ���ܵ�NH3•H2O | B�� | ʵ�����ô���ʯ��������ȡCO2 | ||
| C�� | ���õ��������� | D�� | ������ˮ����Ϊ����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/min | c��CO�� | c��H2O����g�� | c��CO2�� | c��H2�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������̼���ƶ��dz�����θ���кͼ� | |
| B�� | ������أ�K2FeO4����һ�����͡���Ч�����ˮ������������ɱ���������ܾ�ˮ | |
| C�� | ����еĵ����л�ԭ�Զ���ɱ���������� | |
| D�� | �ߴ��ȵĶ�������㷺�����������ά�����ά��ǿ��ǿ����ᡰ��·�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com