
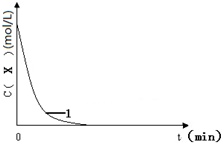
 ��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ���������ټ���˫��ˮ����������Ӧ��H2O2+2H++2I-�T2H2O+I2�������ɵ�I2�������Լ�X��Ӧ�������ģ�һ��ʱ����Լ�X������Ӧ���ɵ�I2��ȫ���ģ�������Һ�е�I-������H2O2���������ɵ�I2��������ã���Һ������������ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㷴ӦH2O2+2H++2I-�T2H2O+I2�ķ�Ӧ���ʣ�
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ���������ټ���˫��ˮ����������Ӧ��H2O2+2H++2I-�T2H2O+I2�������ɵ�I2�������Լ�X��Ӧ�������ģ�һ��ʱ����Լ�X������Ӧ���ɵ�I2��ȫ���ģ�������Һ�е�I-������H2O2���������ɵ�I2��������ã���Һ������������ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㷴ӦH2O2+2H++2I-�T2H2O+I2�ķ�Ӧ���ʣ�| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0.1 mol?L-1 KI��Һ | H2O | 0.01 mol?L-1 X ��Һ | 0.1 mol?L-1 ˫��ˮ | 1 mol?L-1 ϡ���� | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | �� | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | �� | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | �� | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5��Fe2��SO4��3 | 0.6 |
| ����¯�в���H2 |
| ͨ��ˮ��������Ҫ��ѧ��Ӧ�� ��C��s��+H2O��g���TCO��g��+H2��g�� ��H=+131.6kJ mol-1 ��CO��g��+H2O��g���TCO2��g��+H2��g�� ��H=-41.2kJ mol-1 ��CaO��s��+CO2��g���TCaCO3��s�� ��H=-178.3kJ mol-1 |
| 5.0��10-5mol |
| 0.1mol/L |
| 0.01mol/L��0.01L |
| 0.08L��2.8min |
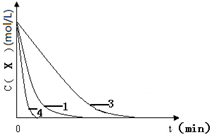 �ʴ�Ϊ��
�ʴ�Ϊ�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��BaSO4��NaCl��NaHCO3������ǿ����� |
| B��SO2��NO2��NO�����ڶ�����Ⱦ�� |
| C��NaHCO3��NH4Cl����NH4��2CO3���ֹ������Ⱥ������ʣ�� |
| D��FeCl2��NaHSO3��Fe��OH��3������ͨ�����Ϸ�Ӧֱ���Ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
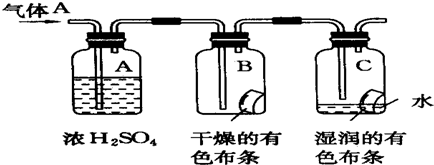
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ҽ��ҩƷӦ�ڵ��¡�����Ļ������ܷⱣ�� |
| B����Ӧ�е�ijһ���ʵ�ת���ʦ���B��������÷�Ӧ��ƽ�ⳣ��Kһ������ |
| C����һ�����𡰹ķ硱��������������ȼ����ȥ |
| D������MnO2��ĩ����ʹ����������ٷֽ⣬��MnO2�������ڷ�Ӧǰ��û�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
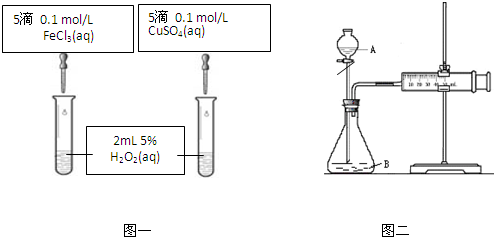
| 1 |
| 2 |
| �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| ͭƽ���ܽ����� ����10-3 mol?L-1?min-1�� | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
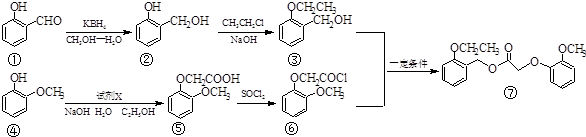
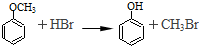
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
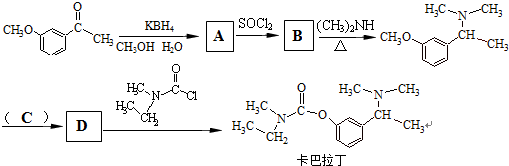
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
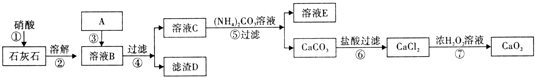
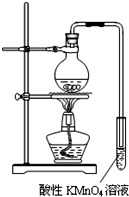 ijѧϰС��̽�����������ȥ��Ӧ����֤���
ijѧϰС��̽�����������ȥ��Ӧ����֤���| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ħ����7������������֮һ |
| B��18 gˮ�ڱ�״���µ����ԼΪ22.4 L |
| C��27 g AlԼ����6.02��1023����ԭ�� |
| D������0.1 mol/L��NaCl��Һ��NaCl���������Ϊ5.85 g |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com