

 .
. .
.分析 A的相对分子质量为104,1mol A与足量的碳酸氢钠反应生成2mol二氧化碳,则A分子含有2个-COOH,去掉2个-COOH剩余总相对原子质量为104-45×2=14,剩余基团为CH2,故A的结构简式为HOOCCH2COOH;B的结构中含有醛基,根据C结构简式结合信息知,B为 ,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息可知,D的结构简式为
,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息可知,D的结构简式为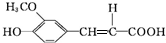 ,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,据此分析解答.
,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,据此分析解答.
解答 解:A的相对分子质量为104,1mol A与足量的碳酸氢钠反应生成2mol二氧化碳,则A分子含有2个-COOH,去掉2个-COOH剩余总相对原子质量为104-45×2=14,剩余基团为CH2,故A的结构简式为HOOCCH2COOH;B的结构中含有醛基,根据C结构简式结合信息知,B为 ,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息可知,D的结构简式为
,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息可知,D的结构简式为 ,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,
,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,
(1)C和酚羟基、碳碳双键,可以发生氧化反应,含有羧基,可以发生酯化反应,醚键很稳定,不易发生水解反应,不能发生消去反应,故选:ad;
(2)C中酚羟基和羧基都与钠反应生成氢气,只有羧基能和碳酸氢钠反应生成二氧化碳,酚羟基和羧基都能与NaOH反应,所以等物质的量的C分别与足量的Na、NaHCO3、NaOH反应消耗Na、NaHCO3、NaOH的物质的量之比是3:2:3,
故答案为:3:2:3;
(3)通过以上分析知,E名称是碳酸氢钠,故答案为:碳酸氢钠;
(4)在一定条件下,A和B反应生成C,反应方程式为: ,
,
故答案为: ;
;
(5)阿魏酸的同分异构体符合下列条件:
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种,说明两个取代基处于对位位置,且两个取代基不同或者两个取代基处于邻位位置,且两个取代基相同,
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体,含有2个-COOH,
所以符合条件的阿魏酸的同分异构体结构简式分别为: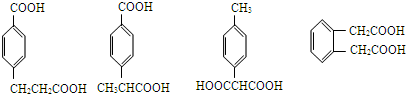 ,所以符合条件的有4种,
,所以符合条件的有4种,
故答案为:4; .
.
点评 本题全面考查了芳香烃、酸、酯的化学性质及转化关系,同时全面考查了各种有机反应类型,如加成反应、氧化反应、酯化反应等;在解这类题目时首先要理解题目中所给信息,特别是所给信息中的断键本质,这样在做后面的题目时才能灵活运用信息解题;在学习过程中一定要掌握它们的代表物的性质,还要熟悉它们之间的相互转化,学会能够根据反应类型、反应条件、反应物或生成的性质进行推测.同时要掌握烃的衍生物的一些特性,这有助于快速找到解题的突破口.


科目:高中化学 来源: 题型:解答题
 (1)写出化学式FNH3,
(1)写出化学式FNH3, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| ①NaCl (Na2SO4) | ||
| ②NaCl(MgCl2) | ||
| ③NaCl(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
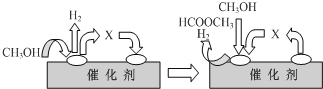
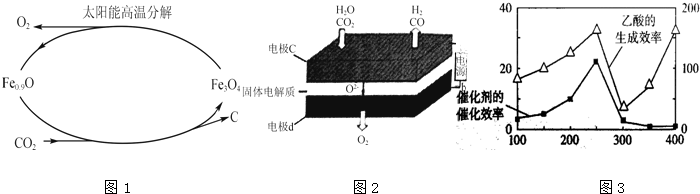
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4lL C2H6所含化学键总数为7 NA | |
| C. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA | |
| D. | 0.1 mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$与Cl-数之和小于0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com