
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO 4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线如图所示,结合各反应的ΔH,归纳lgK-T曲线变化规律:
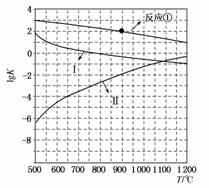
a)__________________________________________________________;
b)_________________________________________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率________(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________________________________________________________________________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________________________。
解析 (1)利用盖斯定律可以计算出所给反应的焓变,要学会利用所给方程式中化学计量数和反应物、中间产物的关系进行解答。根据盖斯定律,由①×4+②+③×2可得目标热化学方程式,故有ΔH=4ΔH1+ΔH2+2ΔH3。(2)该图象只标明反应①的变化趋势,由于反应①是放热反应,可得出“放热反应的lgK随温度的升高而减小,吸热反应的lgK随温度的升高而增大”的结论;由于所给三个热化学方程式中有两个是放热反应,一个是吸热反应,而给出的图象中有两条变化趋势相同,因此可判断曲线Ⅰ代表反应③,曲线Ⅱ代表反应②,通过反应①和反应③曲线相对关系,可得出“同为放热反应,ΔH越大,lgK随温度变化的变化值越小”的结论。(3)由图象可知,当反应①在900 ℃时,lgK=2,即平衡常数K=100。设起始时CO的浓度为a mol·L-1,转化率为x mol·L-1。
1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
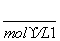 a 0
a 0
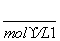 x x
x x
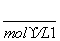 8.0×10-5 x
8.0×10-5 x
根据:K=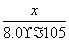 =100,解得x=8.0×10-3。根据:a-x=8.0×10-5,解得a=8.08×10-3。所以CO的转化率=
=100,解得x=8.0×10-3。根据:a-x=8.0×10-5,解得a=8.08×10-3。所以CO的转化率=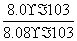 ×100%≈99%。(4)要获得更纯净的二氧化碳,必须减少二氧化硫的量,通过反应②的分析可知,当二氧化碳浓度增大时,可使平衡向左移动,所以可在初始燃料(CO)中加入适量二氧化碳,减少二氧化硫的产生,获得更纯净的二氧化碳。(5)本小题首先确定三点:一是反应物为CaS;二是生成物为CaSO4;三是原子利用率为100%。所以另一种反应物为O2,反应方程式为CaS+2O2
×100%≈99%。(4)要获得更纯净的二氧化碳,必须减少二氧化硫的量,通过反应②的分析可知,当二氧化碳浓度增大时,可使平衡向左移动,所以可在初始燃料(CO)中加入适量二氧化碳,减少二氧化硫的产生,获得更纯净的二氧化碳。(5)本小题首先确定三点:一是反应物为CaS;二是生成物为CaSO4;三是原子利用率为100%。所以另一种反应物为O2,反应方程式为CaS+2O2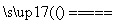 CaSO4;通过分析题给信息可知,生成物为反应物在苯环上引入羧基而得,所以生成物的结构简式为
CaSO4;通过分析题给信息可知,生成物为反应物在苯环上引入羧基而得,所以生成物的结构简式为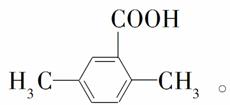
答案 (1)4ΔH1+ΔH2+2ΔH3 (2)放热反应的lgK随温度的升高而减小,吸热反应的lgK随温度的升高而增大 同为放热反应,ΔH越大,lgK随温度变化的变化值越小 (3)由图象可知,当反应①在900℃时,lgK=2,即平衡常数K=100。
设起始时CO的浓度为a mol·L-1,转化量为x mol·L-1。
1/4CaSO4(s)+CO(g)1/4C aS(s)+CO2(g)
aS(s)+CO2(g)
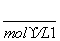 a 0
a 0
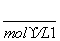 x x
x x
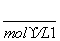 8.0×10-5 x
8.0×10-5 x
根据:K=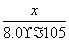 =100,解得x=8.0×10-3。根据:a-x=8.0×10-5,解得a=8.08×10-3。所以CO的转化率=
=100,解得x=8.0×10-3。根据:a-x=8.0×10-5,解得a=8.08×10-3。所以CO的转化率=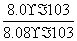 ×100%≈99%。
×100%≈99%。
(4)二氧化碳(或CO2)
(5)CaS+2O2 CaSO4
CaSO4 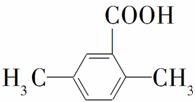


科目:高中化学 来源: 题型:
常温下,下列各组数据中比值为2:1的是( )
A.K2SO3溶液中c(K+)与c(SO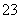 )之比
)之比
B.0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的盐酸中c(H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH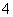 )与c(SO
)与c(SO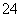 )之比
)之比
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1.12 L CCl4含有C—Cl键数目为0.2NA
B.标准状况下,2.24 L氯气中含有的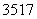 Cl数目一定为 0.2NA
Cl数目一定为 0.2NA
C.常 温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA
温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA
D.80 mL 10 mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是( )
A.v(C)=0.2 mol/(L·min)
B.z=3
C.B的转化率为25%
D.C的体积分数为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)hH(g)达到平衡后,A、B、H的物质的量分别为a mol、b mol和h mol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
A.平衡不移动
B.混合气体的密度不变
C.B的体积分数减小
D.a mol/L<c(A)<2a mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
有0.1mol·L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
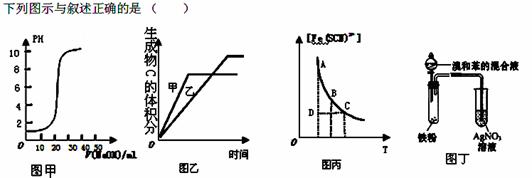
A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大
3C (g)+D (s)的影响且甲的比乙的压强大
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度
Fe(SCN)2+(aq)平衡时,物质的量浓度
[Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆)
D.图丁所示装置可证明溴与苯发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.非金属氧化物均属于酸性氧化物
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.根据电解质的水溶液导电性的强弱,将电解质分为强电解质和弱电解质
D.根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com