
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)> c(CH3COOH) > c(Cl-) >c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
C
解析试题分析:A.根据电荷守恒可得c(OH-)+2c(A2-)=c(H+)+c(Na+)。错误。B.0.1 mol·L-1CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后发生反应CH3COONa+HCl=NaCl+CH3COOH。反应后含CH3COONa、 NaCl、CH3COOH等物质的量混合。因为溶液显酸性,则说明CH3COOH的电离大于CH3COO-水解。所以溶液显酸性。弱电解质的电离程度是很微弱的。所以c(Cl-) >c(H+)、因此该溶液中各离子浓度的大小关系为c(CH3COO-)> c(Cl-) > c(CH3COOH) >c(H+)。C.根据电荷守恒可得①c(Na+)+c(H+) =c(CN-) +c(OH-). 根据物料守恒可得:②2c(Na+)= c(CN-)+c(HCN ) 。将①×2-②可得:c(CN-)+2c(OH-)=2c(H+)+c(HCN)。正确。D. 0.1 mol·L-1(NH4)2Fe(SO4)2的溶液,根据物料守恒可得 c(NH)+c(NH3·H2O)+c(Fe2+)+c(Fe(OH)2)=0.3 mol·L-1.错误。
考点:考查有关溶液中微粒的物质的量浓度关系的知识。


科目:高中化学 来源: 题型:单选题
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
| A.两溶液中水的电离程度相同 |
| B.c(Na+):①>② |
| C.两溶液分别用水稀释10倍后,pH①=pH②<9 |
| D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存 |
| D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对100mL 1mol·L-1的Na2CO3溶液,下列说法不正确的是
A.将溶液稀释,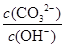 减少 减少 |
| B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一) |
| C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3) |
| D.滴人酚酞,微热,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列混合溶液中,各离子浓度的大小关系不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,离子浓度的大小顺序是 c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| D.NH4Cl溶液中:c(H+) = c(NH3·H2O) +c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)="10.00" mL 时,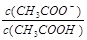 <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
250C时,0.1mol·L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )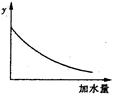
| A.溶液的pH | B.醋酸的电离平衡常数 |
| C.溶液的导电能力 | D.醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
| A.稀释后溶液中c(H+)和c(OH-)均减小 |
| B.稀释后溶液中c(OH-)变为稀释前的1/10 |
| C.稀释过程中氨水的电离平衡向左移动 |
D.稀释过程中溶液中 增大 增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com