
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为_________________个。
(2)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为____________。(水的密度为1g/mL)
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为_________mol/L。
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。请回答下列问题:
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2 (g)+O2 (g) | 工业固氮 N2 (g)+3H2 (g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于 ________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因是 ________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 ________。
(2)已知工业固氮反应:N2(g)+ 3H2(g)![]() 2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
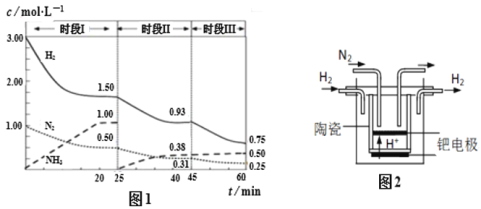
①在2L容器中发生反应,前20min内,ν(NH3) = ________。
②25 min时采取的某种措施是 ________。
③时段III条件下反应的平衡常数为 ________ L2· mol-2(保留3位有效数字) 。
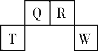
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如图2所示,阴极的电极反应式是 ________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) ΔH2 =-571.6kJ·mol-1
2H2O(l) ΔH2 =-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 糖类、油脂和蛋白质都是天然高分子化合物
B. 煤的干馏和石油的分馏都是化学变化
C. 催化裂化的目的是提高汽油、煤油和柴油等轻质油的产量
D. 由煤的干馏可知煤中含苯、二甲苯等芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
A. R的氢化物可以既有极性键又有非极性键
B. 常温下丁的浓溶液可用T单质所制的容器来盛装
C. 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D. 甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
甲 | 乙 | 丙 | 丁 | ||
起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
含硫反应物的平衡转化率% | 80 |
|
|
| |
下列判断中,正确的是
A. 该温度下,平衡常数的值为400 B. 平衡时,丙中c(SO3)是甲中的2倍
C. 平衡时,ɑ3>ɑ1 D. 乙中SO3的平衡转化率为ɑ1 = 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制480 mL 0.3 mol/L NaOH溶液。具体如下:
(1)需_________g NaOH。
(2)配制过程中,下列仪器不会用到的是_____(填字母),尚缺少的玻璃仪器有_____、______。
A.托盘天平 B.250 mL容量瓶 C.玻璃棒 D.胶头滴管
(3)实验过程中两次用到玻璃棒,其作用分别是: _____________、_______________。
(4)下列操作的正确顺序是:B→_____→_____→____→____→____→G (用字母表示)。
A.冷却 B.称量C.洗涤 D.定容E.溶解 F.转移 G.摇匀
Ⅱ.乙同学用18.4 mol/L浓硫酸配制100 mL 3.6 mol/L的稀硫酸。用100 mL量筒量取20.0 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?________若不正确,指出其中错误之处______。
Ⅲ.在配制物质的量浓度溶液时,判断下列操作出现的后果。(填“偏低”、“偏高”或“无影响”)
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体:________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水:_______。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度:______。
(4)转移时不慎将溶液倒在瓶外:__________;
(5)定容时俯视容量瓶刻度线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a___(填“>”“=”或“<”)b。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将__(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度___(填“>”“=”或“<”)w mol·L-1。
(4)能说明该反应已经达到平衡状态的是___。(填序号,下同)
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是___;能使B的转化率增大的操作是________;使平衡向逆反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d..选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com