
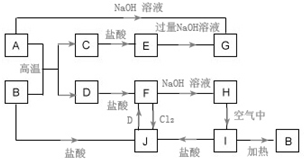
分析 I为红褐色固体,B为红棕色粉末,加热I分解生成B,则I为Fe(OH)3,B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.金属D与J反应生成F,F与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则D为Fe,F为FeCl2,H为Fe(OH)2.金属A与B的反应生成C与D,则C为金属氧化物,C系列转化得到G,而A能与氢氧化钠反应也得到G,故A为Al,C为Al2O3,E为AlCl3,G为NaAlO2,据此解答.
解答 解:I为红褐色固体,B为红棕色粉末,加热I分解生成B,则I为Fe(OH)3,B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.金属D与J反应生成F,F与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则D为Fe,F为FeCl2,H为Fe(OH)2.金属A与B的反应生成C与D,则C为金属氧化物,C系列转化得到G,而A能与氢氧化钠反应也得到G,故A为Al,C为Al2O3,E为AlCl3,G为NaAlO2.
(1)物质G的化学式为:NaAlO2,故答案为:NaAlO2;
(2)反应I→B的化学方程式:2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,故答案为:2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(3)反应H→I是氢氧化亚铁被氧化为氢氧化铁,反应的现象为:白色沉淀迅速变为灰绿色,最后生成红褐色沉淀,故答案为:白色沉淀迅速变为灰绿色,最后生成红褐色沉淀;
(4)反应F→J的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物推断等,难度中等,B、I颜色等为推断突破口,需要学生熟练元素化合物的性质,注意基础知识的积累掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
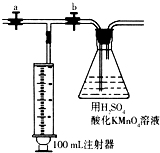 已知常温下甲醛(HCHO)是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛(HCHO)是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | Na2O+H2O=2NaOH | |
| C. | Na2CO3+H2SO4=Na2SO4+CO2↑+H2O | |
| D. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
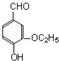 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.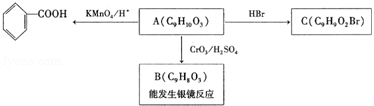
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.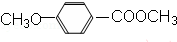 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛(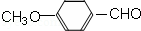 )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).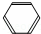 $→_{催化剂△}^{H_{2}}$
$→_{催化剂△}^{H_{2}}$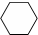 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$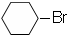
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
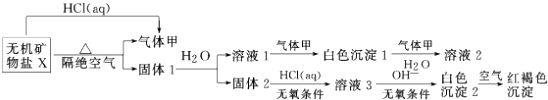
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com