

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F- | |
| C. | H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 | |
| D. | 原子堆积模型如图4,可表示Mg原子的堆积方式 |
分析 A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,据此答题;
B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为$\frac{1}{8}$=4,据此答题;
C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,据此答题;
D.根据晶胞图可知,原子分布在晶胞的顶点和面心上,Mg属于金属晶体,堆积方式是六方最密堆积.
解答 解:A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,1个水合铜离子中有4个配位键,故A正确;
B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为$\frac{1}{8}$=4,2个F-,故B错误;
C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,故C错误;D.根据晶胞图可知,原子分布在晶胞的顶点和面心上,所以该金属晶体为面心立方最密堆积,而Mg的原子堆积叫六方最密堆积,故D错误;
故选A.
点评 本题考查了配合物、离子晶体、电子云、最密堆积等知识,难度不大,解题关键是对图要仔细观察,同时正确理解基本概念.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
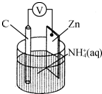
| A. | 碳电极上发生还原反应 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 负极上发生的反应为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡后静置 | 下层呈紫红色 | 氧化性:Fe3+>I2 |
| B | 向稀硫酸中加入少量铁粉 | 溶液变为黄色 | 稀硫酸将Fe氧化成Fe3+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞溶液,然后逐滴加入稀盐酸至红色接近消失时停止,静置 | 试管里出现凝胶 | 非金属性:Cl>Si |
| D | 葡萄糖溶液与新制的氢氧化铜混合加热 | 有砖红色沉淀生成 | 葡萄糖分子中有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com