
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| C. | 中和滴定时.滴定管用所盛装的反应液润洗2~3 次. | |
| D. | 分液操作中,下层液体从下端放出,上层液体从上口倒出 |
分析 A.过滤遵循一贴二低三靠;
B.玻璃棒蘸取待测液,滴在pH试纸上,试纸不能湿润;
C.滴定管用所盛装的反应液润洗,否则浓度变小;
D.分液时避免上下层液体混合.
解答 解:A.过滤遵循一贴二低三靠,则过滤操作中,漏斗的尖端应接触烧杯内壁,防止液滴飞溅,故A正确;
B.玻璃棒蘸取待测液,滴在pH试纸上,试纸不能湿润,湿润的pH试纸测定醋酸的pH偏大,故B错误;
C.滴定管用所盛装的反应液润洗,否则浓度变小,则润洗2~3 次,故C正确;
D.分液时避免上下层液体混合,则下层液体从下端放出,上层液体从上口倒出,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、中和滴定、pH测定等为解答的关键,侧重分析与实验能力的考查,注意实验技能与实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
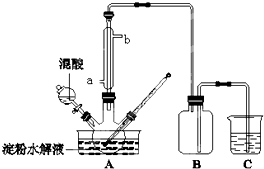 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 将钢闸门与电源正极相连,可防止其在海水中被腐蚀 | |
| D. | 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
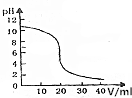 常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )| A. | V=10.00mL时,c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| B. | V=20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗盐酸的体积大于20.00mL | |
| D. | pH=8时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol/LH2SO4 | 若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO |
| C | 淀粉碘化钾溶液久置显蓝色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 向含有少量的FeBr3的FeCl3溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl3溶液中的FeBr3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com