
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |


 CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。

科目:高中化学 来源:不详 题型:单选题
A.对于反应2SO2(g)+O2(g)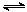 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
| B.电解法精炼铜时,精铜作阳极,粗铜作阴极 |
| C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
D.CH3COOH溶液加水稀释后,电离程度增大,溶液中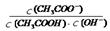 的值不变 的值不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) CH4(g)+ H2O (g)
CH4(g)+ H2O (g) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据图①可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH<0 |
| B.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液的pH随加入酸体积的变化 |
| C.根据图③(S表示溶解度),A点表示T1oC时甲为饱和溶液,乙溶液未饱和。 |
D.根据图④可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
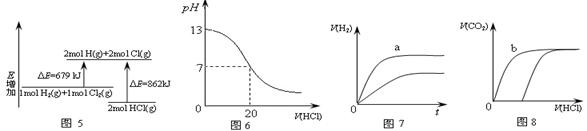
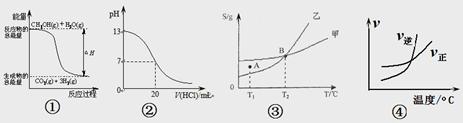
| A.图5表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H =183kJ·mol-1 |
| B.图6表示室温时用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液pH随加入酸体积变化 |
| C.图7表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.图8表示10mL0.1mol/LNa2CO3和NaHCO3两种溶液中,分别滴加0.1mol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com