
如下图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
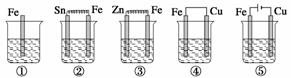
A.⑤②①③④ B.④③①②⑤ C.⑤④②①③ D.③②④①⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2(g)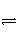
 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 碱性锌锰干电池是二次电池
B. 铅蓄电池是一次电池
C. 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D. 燃料电池的活性物质没有储存在电池内部
查看答案和解析>>
科目:高中化学 来源: 题型:
某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是( )
A.加入的酸过量
B.生成的盐不水解
C.酸和碱等物质的量混合
D.反应后溶液中[A-]=[M+]
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是H2A===H++HA-;HA-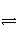

H++A2-。
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)________________________________________________________________________。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能__________0.11 mol·L-1(填“>”、“=”或“<”),理由是
________________________________________________________________________
__________________。
(3)0.1 mol·L-1 NaHA的溶液中各种离子浓度由大到小的顺序是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了避免青铜器生成铜绿,以下方法正确的是( )
①将青铜器放在银质托盘上 ②将青铜器保存在干燥的环境中 ③将青铜器保存在潮湿的空气中 ④在青铜器的表面覆盖一层防渗的高分子膜
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com