
| A. | ①③ | B. | ①② | C. | ②③ | D. | ③④ |
分析 活泼金属和活泼非金属元素之间易形成离子键,可以组成AB2型离子化合物,说明两种元素一种是活泼金属元素一种是活泼非金属元素,A是+2价,B是-1价,以此来解答.
解答 解:①6号元素是C,8号元素是O,二者能形成AB2型共价化合物,故不选;
②12号元素是Mg元素,17号元素是Cl元素,二者形成的化合物是MgCl2,镁元素和氯元素易形成离子键,故选;
③20号元素是Ca,9号元素是F元素,二者形成形成AB2型离子化合物CaF2,故选;
④11号元素是Na,17号元素是Cl,二者形成化合物离子化合物为NaCl,故不选;
故选C.
点评 本题考查元素的推断及化学键,为高频考点,把握原子序数判断元素是解本题关键,注意元素的金属性、非金属性强弱判断形成的化学键类型,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下作用铝槽贮运浓硫酸 | |
| B. | 金属钠着火时,用细沙覆盖灭火 | |
| C. | 铝制容器不能盛装酸性溶液,可以盛装碱性溶液 | |
| D. | 碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中铜和铁各0.075mol | |
| B. | 稀硝酸的物质的量浓度为2.0mol•L-1 | |
| C. | 第一次剩余4.8g金属为铜和铁 | |
| D. | 向反应后的溶液中再加入该稀硝酸100mL,又得到NO在标准状况下体积小于1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)>K(HY) | D. | HX、HY、HZ的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金 | B. | 复合材料 | C. | 纯净物 | D. | 有机材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | CO2通入水玻璃中可得硅酸 | |
| C. | 因高温时,SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 石英是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可以利用如图所示装置制备氯气.
实验室可以利用如图所示装置制备氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

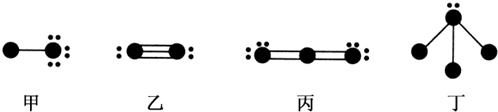
| A. | 通常状况下在水中溶解度丙大于丁 | |
| B. | 甲、乙、丙为非极性分子,丁为极性分子 | |
| C. | 甲的水溶液中存在4种氢键 | |
| D. | 甲中电负性小的元素与丙中电负性大的元素形成的化合物一定不存在极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com