
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中 A、F 为氨气和氯气的发生装置,C 为纯净、干燥的氯气与氨气反应的装置。
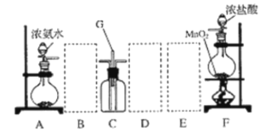
请回答下列问题:
(1)装置 F 中发生反应的离子方程式是______________。
(2)装置 A 中的烧瓶内固体可选用_______________(选填以下选项的代号)。
A 碱石灰 B 浓硫酸 C 生石灰 D 五氧化二磷 E 烧碱
(3)虚线框内应添加必要的除杂装置,请从图的备选装置中选择,并将编号填入下列空格:
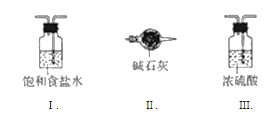
B___D____E_____
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ________;装置 C 内出现浓厚的白烟,该物质化学式为_________。
(5)若从装置 C 中 G 处逸出的尾气中含有 N2 和少量 C12,应如何处理________。
【答案】![]() ACE II III I
ACE II III I ![]()
![]() 在G处接一个盛有氢氧化钠溶液的洗气瓶
在G处接一个盛有氢氧化钠溶液的洗气瓶
【解析】
根据题意,A为氨气的固液不加热制取装置,B为氨气的干燥装置,F为氯气的实验室制取装置,D、E则为氯气的除杂、干燥装置,据此来分析本题即可。
(1)装置F即氯气的实验室制取,用二氧化锰和浓盐酸在加热的情况下反应,离子方程式为![]() ;
;
(2)氨气是一种碱性气体,因此不能选用浓硫酸、五氧化二磷这两种酸性物质,而碱石灰、生石灰和烧碱均是碱性物质且可以促进氨水分解得到氨气,答案选ACE;
(3)A中出来的氨气只需进行简单干燥即可,考虑到氨气是碱性气体,因此我们选用装有碱石灰的球形干燥管,而F中出来的氯气混有水分和![]() 气体,需要先通入饱和食盐水溶液来洗去
气体,需要先通入饱和食盐水溶液来洗去![]() ,再通过浓硫酸来干燥(注意顺序不能反);
,再通过浓硫酸来干燥(注意顺序不能反);
(4)氯气具有强氧化性,而氨气中的氮原子是-3价的,具有一定的还原性,二者发生氧化还原反应![]() ,烟即固体小颗粒,在该体系中只有
,烟即固体小颗粒,在该体系中只有![]() 是固体;
是固体;
(5)氮气不会污染环境,只需处理掉尾气中的![]() 即可,我们可以选用氢氧化钠溶液来吸收
即可,我们可以选用氢氧化钠溶液来吸收![]() 。
。


科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
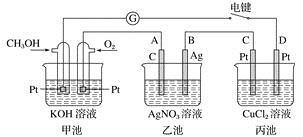
请回答下列问题:
![]() 甲池为________
甲池为________![]() 填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池”![]() ,通入
,通入![]() 电极的电极反应式为__________。
电极的电极反应式为__________。
![]() 乙池中
乙池中![]() 石墨
石墨![]() 电极的名称为________
电极的名称为________![]() 填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极”![]() ,总反应式为_______。
,总反应式为_______。
![]() 当乙池中B极质量增加
当乙池中B极质量增加![]() 时,甲池中理论上消耗
时,甲池中理论上消耗![]() 的体积为________
的体积为________![]() 标准状况下
标准状况下![]() ,丙池中________极析出________g铜。电键闭合一段时间后,甲中溶液的pH将________
,丙池中________极析出________g铜。电键闭合一段时间后,甲中溶液的pH将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。 请回答:

(1)B极是电源的__________极,C极的电极反应式为____________________________________,一段时间后丁中X极附近的颜色逐渐______________。(填“变深”或者“变浅”)
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ______________。
(3)现用丙装置给铜件镀银,则H应该是______________ (填“铜”或“银”),电镀液是___________ 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为________ g,甲中溶液的pH _____________(填“变大”、“变小”或“不变”)。
(4)若甲烧杯是在铁件表面镀铜,已知电镀前两电极质量相同,电镀完成后将它们取出,洗净、烘干、称量,发现二者质量相差5.12g,则电镀时电路中通过的电子为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体 A 的化学式为 NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,则下列有关说法不正确的是( )
A.NH5 中既有共价键又有离子键,NH5 是离子化合物
B.1 mol NH5 中含有 5NA 个 N—H 键(NA 表示阿伏加德罗常数)
C.NH5 的电子式为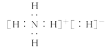
D.A 与水反应的化学方程式为 NH5+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.向AgCl浊液中加入少量KI溶液,可看到白色沉淀变为黄色沉淀
B.高压比常压更有利于N2和H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
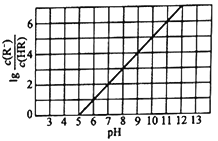
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
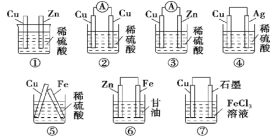
A. ③⑤⑦B. ③④⑤C. ④⑤⑦D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2OD.NH3+CO2+H2O=NH4HCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com