
(8分)使一定量Zn与100 ml 18.5 mol/L浓H2SO4充分反应,Zn完全溶解,同时生成标准状况下气体33.6L。将反应后溶液稀释至1L,测得其c(H+) = 0.1mol/L。求:
(1)生成气体的成分为: ;
(2)Zn的质量为 g;
(3)开始生成H2时H2SO4的浓度为 mol/L。(假设溶液体积无变化)
(1) SO2 ,H2(2分 (2) 97.5(3分) (3) 12.5(3分)
【解析】考查根据化学反应方程式进行的有关计算。浓硫酸属于氧化性酸,和锌反应生成SO2。但随着反应的进行,硫酸的浓度会逐渐降低,当浓度降低到一定程度后,就变成稀硫酸。稀硫酸和锌反应生成的是氢气,即33.6L气体是SO2和氢气的混合气。反应前硫酸的物质的量是0.1L×18.5mol/L=1.85mol,反应后硫酸的物质的量是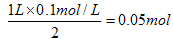 ,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
Zn+2H2SO4(浓) ZnSO4+2H2O+SO2↑
、 Zn+H2SO4=ZnSO4+H2↑
ZnSO4+2H2O+SO2↑
、 Zn+H2SO4=ZnSO4+H2↑
1mol 2mol 1mol 1mol 1mol 1mol
X 2x x y y y
所以有x+y=1.5mol和2x+y=1.8mol
解得x=0.3mol y=1.2mol
所以锌的质量是(x+y)×65g/mol=97.5g
当开始生成氢气时溶液中的硫酸是1.85mol-2x=1.25mol
所以浓度是12.5mol/L


科目:高中化学 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(带解析) 题型:计算题
(8分)使一定量Zn与100 ml 18.5 mol/L浓H2SO4充分反应,Zn完全溶解,同时生成标准状况下气体33.6L。将反应后溶液稀释至1L,测得其c(H+) = 0.1mol/L。求:
(1)生成气体的成分为: ;
(2)Zn的质量为 g;
(3)开始生成H2时H2SO4的浓度为 mol/L。(假设溶液体积无变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com