
分析 (1)当产生沉淀达到最大值的时候,n(NaOH)=3n(AlCl3),然后根据c=$\frac{n}{V}$来求解;
(2)由于沉淀产生不是最大值,故0.15 mol为两种情况,即:一种是产生沉淀的过程中,另一种是沉淀溶解过程中,由此分析解答.
解答 解:(1)n(AlCl3)=c(AlCl3)•V(AlCl3)=0.2L×1mol/L=0.2mol,沉淀达到最大值时,即铝离子完全沉淀时,由方程式可知:
3NaOH+AlCl3 =Al(OH)3+3NaCl…(1分)
3 1
n(NaOH) n(AlCl3)
所以$\frac{3}{n(NaOH)}=\frac{1}{n(AlC{l}_{3})}$;则n(NaOH)=0.6mol
c(NaOH)=$\frac{n}{V}$=$\frac{0.6mol}{0.3L}$=2 mol/L,
答:NaOH溶液的浓度是 2 mol/L;
(2)第一种情况,产生沉淀的过程中:
3NaOH+AlCl3=Al(OH)3+3NaCl
3 1
n(NaOH) 0.15 mol
所以$\frac{3}{n(NaOH)}=\frac{1}{0.15}$,解之得:n(NaOH)=0.45mol,
V(NaOH)=$\frac{0.45mol}{2mol/L}$=0.225L,即V(NaOH)=225mL;
第二种情况,产生沉淀的过程中:已知,产生Al(OH)3最大值n=0.2mol
则用于溶解Al(OH)3消耗的NaOH的物质的量为:
NaOH+Al(OH)3=NaAlO2+2H2O…(1分)
1 1
n(NaOH) (0.2-0.15)mol
$\frac{1}{n(NaOH)}=\frac{1}{(0.2-0.15)mol}$,所以n(NaOH)=0.05mol,所以NaOH总共消耗n(NaOH)=0.05+0.6=0.65mol
V(NaOH)=$\frac{0.65mol}{2mol/L}$=0.325L,即V(NaOH)=325mL,
答:NaOH溶液的体积是225mL或325mL.
点评 本题考查方程式的有关计算,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{3b}{0.0224V}$ | B. | e=a+$\frac{8cV}{1000}$ | C. | d=a+$\frac{17cV}{1000}$ | D. | $\frac{82a}{65}$<e<$\frac{5a}{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、油脂、天然橡胶和蛋白质分子中均含有双键 | |
| B. | 相同物质的量的甲基、羟基或氨基所含的电子数目相同 | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数不为定值 | |
| D. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团的类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
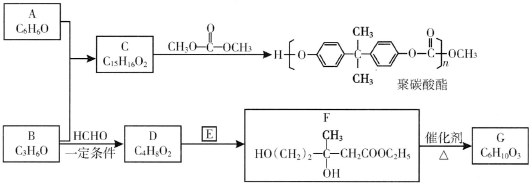
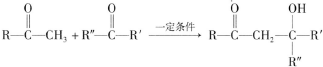 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基)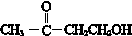 ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应?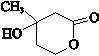 .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
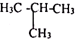 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com