
| A、2H2(g)+O2(g)=2H2O(l) 2H2(g)+O2(g)=2H2O(g) | ||||
B、H2(g)+Cl2(g)=2HCl(g)
| ||||
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) NaOH(aq)+
| ||||
D、C(s)+
|
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、绿色食品是不含任何化学物质的食品 |
| B、Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 |
| C、与同浓度的硫酸反应时,NaHCO3比Na2CO3剧烈 |
| D、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤⑥ |
| C、①③④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
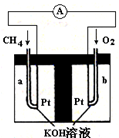 燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.
燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.查看答案和解析>>
科目:高中化学 来源: 题型:
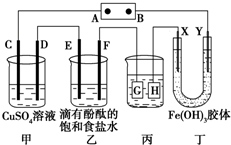 如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2A13++3SO42-+3Ba2++6OH-→2A1(OH)3↓+3BaSO4↓ |
| B、A13++2SO42-+2Ba2++3OH-→A1(OH)3↓+2BaSO4↓ |
| C、A13++SO42-+Ba2++4OH-→A1O2-+BaSO4↓+2H2O |
| D、A13++2SO42-+2Ba2++4OH-→A1O2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子数相同,分子数不同 |
| B、质量相同,电子数不同 |
| C、原子数相同,质子数不同 |
| D、分子数相同,质量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
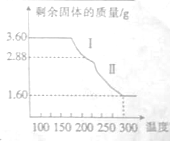 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com